
【题目】【上海市浦东新区六校2017届高三下学期第二次学科调研考试】工业上常用如下的方法从海水中提碘:

完成下列填空:
(1)上述流程中有两步都涉及到氯气。写出氯元素在周期表中的位置:_________;
氯气分子中所含的化学键名称是:_________;在![]() 原子钟,其核外存在_________种运动状态不同的电子。
原子钟,其核外存在_________种运动状态不同的电子。
(2)和氯元素位于同主族的另外一个短周期元素单质的电子式是:_________,
两者气态氢化物的稳定性是:_________>_________(填写化学式)。
(3)步骤②中体现了溴具有的性质是_______________(文字简述)。
(4)写出步骤③中反应的化学方程式(说明:此反应在水溶液中进行):________________;在该反应中被氧化的元素是:_________。
(5)工业上利用海水还有一个重要的反应就是电解饱和食盐水,此反应中的阴极产物是:_________和_________(写化学式)。
(6)溴蒸汽还可以用饱和碳酸钠溶液来吸收,产物为溴化钠、溴酸钠,同时放出二氧化碳,请写出该反应的化学方程式并标明电子转移方向与数目:______________________。
【答案】 第三周期第ⅦA族 共价键 17 ![]() HF HCl 沸点低,易挥发 Br2+SO2+2H2O→H2SO4+2HBr S H2 NaOH
HF HCl 沸点低,易挥发 Br2+SO2+2H2O→H2SO4+2HBr S H2 NaOH ![]()
【解析】(1)氯元素核电荷数17,原子核外三个电子层,最外层电子数7个,位于周期表中第三周期第ⅤⅡA,氯气分子中氯原子间相处一对共用电子对,形成一个共价键,氯原子核外17个电子,其核外存在17种运动状态不同的电子,故答案为:第三周期第ⅤⅡA;共价键;17;
(2)和氯元素位于同主族的另外一个短周期元素单质为F2,氟原子间形成一对共用电子对,电子式为,![]() ,非金属性越强氢化物稳定性越强,两者气态氢化物的稳定性是HF>HCl,故答案为:
,非金属性越强氢化物稳定性越强,两者气态氢化物的稳定性是HF>HCl,故答案为:![]() ;HF;HCl;
;HF;HCl;
(3)步骤②中用空气和水蒸气将溴吹出,并用SO2氧化吸收,从而达到富集溴,体现了溴具有的性质是沸点低,易挥发,故答案为:沸点低,易挥发;
(4)步骤③中反应是溴单质和二氧化硫在水溶液中发生氧化还原反应生成硫酸和溴化氢,反应的化学方程式为:Br2+SO2+2H2O=H2SO4+2HBr,反应中被氧化的元素是S元素,化合价+4价变化为+6价,故答案为:Br2+SO2+2H2O=H2SO4+2HBr;S;
(5)电解饱和食盐水溶液中氯离子在阳极失电子被氧化生成氯气,氢离子在阴极得到电子生成氢气被还原,水电离平衡正向进行,溶液中氢氧根离子浓度增大溶液中生成氢氧化钠,故答案为:H2;NaOH;
(6)吹出Br2后用碳酸钠溶液吸收,形成溴化钠和溴酸钠,同时有CO2放出,反应的化学方程式为:3Br2+3Na2CO3═5NaBr+NaBrO3+3CO2↑,溴元素0价变化为-1价和+5价,电子转移总数5e-,该反应的化学方程式并标明电子转移方向与数目为:![]() ,故答案为:
,故答案为:![]() 。
。
【名师点评】本题考查了海水资源及其综合利用,涉及的知识点较多。清楚流程中的反应原理是解题的关键。浓缩后增大溴离子的浓度,与氯气发生2Br-+C12=Br2+2Cl-,用空气和水蒸气将溴吹出,并用SO2氧化吸收,从而达到富集溴,③中发生Br2+2H2O+SO2═2HBr+H2SO4,④中发生Cl2+2HBr=Br2+2HCl。


科目:高中化学 来源: 题型:
【题目】(8分)原子序数11~17的元素,自钠到氯,电子层数相同,最外层电子数从 增加到 ,随着核电荷数依次递增,原子半径依次 ,核对外层电子的引力逐渐 ,失电子能力逐渐 ,得电子能力逐渐 ,因此,金属性逐渐 ,非金属性逐渐 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 金属发生吸氧腐蚀时,被腐蚀的速度与氧气浓度无关
B. 某吸热反应能自发进行,因此该反应是熵增反应
C. 一定条件下N2(g)+3H2(g) ![]() 2NH3(g)反应达平衡时,3v正(H2)= 2v逆(NH3)
2NH3(g)反应达平衡时,3v正(H2)= 2v逆(NH3)
D. 原电池中发生的反应达平衡时,该电池仍有电流产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【黑龙江省双鸭山市第一中学2017届高三全真模拟(第四次)考试理科综】化学是你,化学是我,化学深入我们的生活。下列说法正确的是( )
A. 常温下,纯水的电离度为10-7×100%
B. 不能用溴水区分生物柴油和汽油
C. 海水淡化可使用冷冻法、离子交换法、电解法、反渗透法、明矾吸附法
D. 开发可燃冰,有利于节省化石燃料,并减少温室效应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【上海市闵行区2017届高三上学期期末教学质量调研(一模)化学试题】利用海水可以提取氯化钠、溴、碘等产品。海带提碘的流程如下:
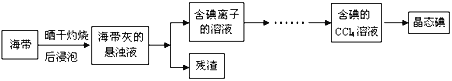
(1)CCl4含有___________键的______________分子(均选填“极性”或“非极性”)。
(2)灼烧海带时除需要三脚架、酒精灯、泥三角外,还需要的主要仪器是____________。
(3)为更好的完成实验,灼烧海带时,需加入一定量的氢氧化钠充分混合后再灼烧。此操作目的是___________________________________。
(4)向盛有碘离子溶液中加入CCl4和氯水,______(填:“上”或“下”)层呈紫红色;如果氯水加过量,CCl4层会由紫红色变成无色。整个过程中被氧化的微粒是__________________。写出并配平CCl4层由紫红色变成无色的化学反应方程式:__________
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学药品的使用正确的是( )
A. 固体药品应盛放在细口瓶中
B. 将鼻孔凑到集气瓶口闻气体的气味
C. 给试管内液体加热,液体量不超过试管容积的三分之二
D. 一般用药匙或镊子取用固体药品
查看答案和解析>>
科目:高中化学 来源: 题型:
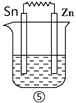
【题目】氧化还原反应与电化学及金属的防护知识密切相关。请回答下列问题:

Ⅰ、依据反应: 2Ag+(aq)+Cu=== Cu2+ (aq) +2Ag设计的原电池如图1所示。则电解质溶液Y是___________ (填化学式),X的电极反应式__________________。若将盐桥换成铜丝,则X电极名称是____________。
Ⅱ、 用图2的装置进实验。
(1)若A为Zn,实验时开关K与a连接,则能模拟钢铁的一种电化学防护方法,名称为______。
(2)若A为石墨,将开关K与b连接,则有关该实验的说法正确的是(填序号)________。
①溶液中Na+向A极移动
②从A极处逸出的气体能使湿润的蓝色石蕊试纸先变红后褪色
③反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
④若标准状况下B极产生2.24 L气体,则电路中转移0.2 mol电子
⑤电子流动方向:电源负极→B→饱和食盐水→A→电源正极
⑥若实验前滴入酚酞,B极区附近溶液先变红
Ⅲ、 如下图所示装置中都盛有0.1 mol/L的NaCl溶液,放置一定时间后,装置中的五块相同锌片,腐蚀速率由快到慢的正确顺序是______________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作所用仪器合理的是( )
A. 用25 mL烧杯量取14.80 mL 氢氧化钠溶液
B. 用10 mL量筒量取5.0 mL盐酸
C. 用托盘天平称取25.20 g 碳酸钠
D. 用100 mL容量瓶配制50 mL 0.10 mol·L-1氯化钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2017届宁夏六盘山高级中学高三上月考二化学卷】研究NOx、CO等大气污染物的测量及处理具有重要意义。
(1)在汽车尾气系统中装置催化转化器,可有效降低NOx的排放。NOx在催化转化器中被CO还原成N2排除。写出NO被CO还原的化学方程式:________________。
(2)选择性催化还原技术(SCR)是目前最成熟的烟气脱硝技术,即在金属催化剂作用下,用还原剂(如NH3)选择性地与NOx反应生成N2和H2O。
①已知:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)△H=-905.5kJmol-1
4NO(g)+6H2O(g)△H=-905.5kJmol-1
N2(g)+O2(g)![]() 2NO(g)△H=+180kJmol-1
2NO(g)△H=+180kJmol-1
完成该方法中主要反应的热化学方程式
4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g)△H=_________________。
4N2(g)+6H2O(g)△H=_________________。
②该方法应控制反应温度在315~400℃之间,反应温度过低会影响反应速率,但温度也不宜过高,原因是___________________。
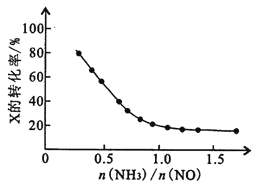
③氨氮比[n(NH3)/n(NO)]会直接影响该方法的脱硝率。350℃时,只改变氨气的投放量,反应物x的转化率与氨氮比的关系如图所示,则X是________________ (填化学式)。当n(NH3)/n(NO)>1.0时,烟气中NO浓度反而增大,主要原因是________________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com