
����Ŀ����2017����������ɽ����ѧ�������¿�����ѧ�����о�NOx��CO�ȴ�����Ⱦ��IJ���������������Ҫ���塣
��1��������β��ϵͳ��װ�ô�ת����������Ч����NOx���ŷš�NOx�ڴ�ת�����б�CO��ԭ��N2�ų���д��NO��CO��ԭ�Ļ�ѧ����ʽ��________________��
��2��ѡ���Դ���ԭ����(SCR)��Ŀǰ�����������������������ڽ������������£��û�ԭ��(��NH3)ѡ���Ե���NOx��Ӧ����N2��H2O��
����֪��4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)��H=-905.5kJmol-1
4NO(g)+6H2O(g)��H=-905.5kJmol-1
N2(g)+O2(g)![]() 2NO(g)��H=+180kJmol-1
2NO(g)��H=+180kJmol-1
��ɸ÷�������Ҫ��Ӧ���Ȼ�ѧ����ʽ
4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g)��H=_________________��
4N2(g)+6H2O(g)��H=_________________��
���÷���Ӧ���Ʒ�Ӧ�¶���315~400��֮�䣬��Ӧ�¶ȹ��ͻ�Ӱ�췴Ӧ���ʣ����¶�Ҳ���˹��ߣ�ԭ����___________________��
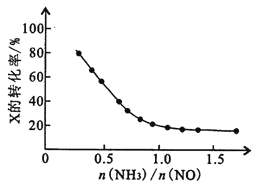
��������[n(NH3)��n(NO)]��ֱ��Ӱ��÷����������ʡ�350��ʱ��ֻ�ı䰱����Ͷ��������Ӧ��x��ת�����백���ȵĹ�ϵ��ͼ��ʾ����X��________________ (�ѧʽ)����n(NH3)��n(NO)��1.0ʱ��������NOŨ�ȷ���������Ҫԭ����________________ ��
���𰸡���1��NO+CO![]() N2+CO2��2����-1265.5kJ/mol
N2+CO2��2����-1265.5kJ/mol
���¶ȹ��ͣ���Ӧ����С���¶ȹ��ߣ�ʹ��������Ҫ��Ӧ��ƽ�����淽���ƶ��������ʽ��ͣ�
��NH3 ����������������Ӧ����NO
��������
�����������1���������⣬NO��CO��ԭ��N2����Ӧ�Ļ�ѧ����ʽΪNO+CO![]() N2+CO2��
N2+CO2��
��2������֪��4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)��H=-905.5kJmol-1����N2(g)+O2(g)
4NO(g)+6H2O(g)��H=-905.5kJmol-1����N2(g)+O2(g)![]() 2NO(g) ��H=+180kJmol-1�������ݸ�˹������-����2�ɵ�4NH3(g)+4NO(g)+O2(g)
2NO(g) ��H=+180kJmol-1�������ݸ�˹������-����2�ɵ�4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g)��H=��-905.5kJmol-1��-��+180kJmol-1����2=-1265.5kJ/mol��
4N2(g)+6H2O(g)��H=��-905.5kJmol-1��-��+180kJmol-1����2=-1265.5kJ/mol��
���÷���Ӧ���Ʒ�Ӧ�¶���315��400��֮�䣬��Ӧ�¶Ȳ��˹���Ҳ���˹��ߣ��¶�Խ�߷�Ӧ����Խ�죬�¶ȹ��ͣ���Ӧ����С���¶ȹ��ߣ�ʹ��������Ҫ��Ӧ��ƽ�����淽���ƶ��������ʽ��͡�
��������[n(NH3)��n(NO)]Խ�����������ʵ���Խ������ת����ԽС����ͼ��֪�����Ű�����Ũ�ȵ�����X��ת���ʼ�С������XΪNH3����[n(NH3)��n(NO)]��1.0ʱ��������������Ӧ����NO������������NOŨ������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ϻ����ֶ�������У2017�������ѧ�ڵڶ���ѧ�Ƶ��п��ԡ���ҵ�ϳ������µķ����Ӻ�ˮ����⣺

���������գ�
(1)�������������������漰��������д����Ԫ�������ڱ��е�λ�ã�_________��
���������������Ļ�ѧ�������ǣ�_________����![]() ԭ���ӣ���������_________���˶�״̬��ͬ�ĵ��ӡ�
ԭ���ӣ���������_________���˶�״̬��ͬ�ĵ��ӡ�
��2������Ԫ��λ��ͬ���������һ��������Ԫ�ص��ʵĵ���ʽ�ǣ�_________��
������̬�⻯����ȶ����ǣ�_________��_________����д��ѧʽ����
��3��������������������е�������_______________�����ּ�������
��4��д���������з�Ӧ�Ļ�ѧ����ʽ��˵�����˷�Ӧ��ˮ��Һ�н��У���________________���ڸ÷�Ӧ�б�������Ԫ���ǣ�_________��
��5����ҵ�����ú�ˮ����һ����Ҫ�ķ�Ӧ���ǵ�ⱥ��ʳ��ˮ���˷�Ӧ�е����������ǣ�_________��_________��д��ѧʽ����
��6���������������ñ���̼������Һ�����գ�����Ϊ�廯�ơ������ƣ�ͬʱ�ų�������̼����д���÷�Ӧ�Ļ�ѧ����ʽ����������ת�Ʒ�������Ŀ��______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڻ�ѧʵ���˵����ȷ����
A. ���κ���ҺpHʱ����ʹ�ù㷺pH��ֽ����pH��ֽ
B. ��ˮ�Ȼ��ƿɸ���CO2��Cl2��NH3��CO�ȳ�������
C. �þƾ��Ƽ�����ƿ���ձ����Թ�ʱ����Ҫ��ʯ����
D. ��ȡ�����˶����������ʵ��������ʽ��з���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͬ�����£�ag��A������bg��B����ռ����ͬ�������������������� (����)
A. a��b����A��B����Է�������֮��
B. a��b���ڵ�������A��B�ķ�����֮��
C. a��b����ͬ��ͬѹ��A��B���ܶ�֮��
D. b��a����ͬ��ͬ�����������A��B��ѹǿ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���ȼ���ȵ�˵������ȷ���ǣ� ��
A.ȼ������ָ1mol����ȼ�����ų�������
B.ȼ������ָ�����£���ȼ��ȼ�շų�������
C.ȼ������ָ1.01��105Paʱ��1mol��������ȫȼ�������ȶ���������ʱ���ų�������
D.ȼ�����滯ѧ�������ĸı���ı�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��300 ml 0.1 mol��L��ALCl3��Һ��200 ml 0.3 mol��L��NaCl��Һ��c��Cl-��֮��Ϊ
A. 1��1 B. 1��2 C. 1��3 D. 3��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2015����ͨ�ߵ�ѧУ����ȫ��ͳһ���ԣ����վ�����һ������̼����ȼ�ϵ��ԭ��ʾ����ͼ�������йظõ�ص�˵����ȷ���ǣ� ��
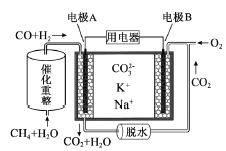
A����ӦCH4��H2O![]() 3H2��CO,ÿ����1molCH4ת��12mol ����
3H2��CO,ÿ����1molCH4ת��12mol ����
B���缫A��H2����ĵ缫��ӦΪ��H2��2OH����2e��=2H2O
C����ع���ʱ��CO32����缫B�ƶ�
D���缫B�Ϸ����ĵ缫��ӦΪ��O2��2CO2��4e��=2CO32��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ǧ�����dz��õĻ�ѧ��Դ����缫���Ϸֱ���Pb��PbO2 �� ���ҺΪϡ���ᣮ�ŵ�ʱ���õ���ܷ�ӦʽΪ��Pb+PbO2+2H2SO4 ![]() 2PbSO4+2H2O���������������жϣ�
2PbSO4+2H2O���������������жϣ�
��1�������صĸ��������� �� �ŵ�ʱ���������������ԭ������Ӧ��
��2�������طŵ�ʱ���������Һ�����������������С�����䡱�����������Һ�����������������������������
��3����֪����ǦΪ������ˮ�İ�ɫ����������ʱ�����ڵ缫�ϣ���д���õ�طŵ�ʱ�������ĵ缫��Ӧ�������ӷ���ʽ��ʾ����
��4������ȼ�ϵ�ؾ��������졢Ч�ʸߵ��ŵ㣬�������ܶȸ���Ǧ���أ��������ΪKOH��Һ��������ȼ�ϵ�صĸ�����ӦʽΪ �� �õ�ع���ʱ�����·ÿ����1��103 mol e�� �� ���ı��������m3 ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2���ȱ���Ϊ��Ҫԭ����ȡ1��2��������CH3CH��OH��CH2OHʱ�������ķ�ӦΪ�� ��
A. �ӳ�����ȥ��ȡ�� B. ȡ�����ӳ�����ȥ
C. ȡ������ȥ���ӳ� D. ��ȥ���ӳ���ȡ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com