
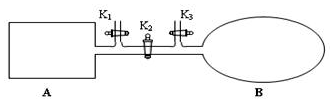
 我国于2016年10月17日在酒泉卫星发射中心由“长征二号”FY11运载火箭发射“神舟十一号”载人飞船.“长征二号”FY11运载火箭使用的氧化剂是N2O4.如图,A是由导热材料制成的恒容密闭容器,B是一耐化学腐蚀且易于传热的透明气囊.关闭K2,通过K1、K3分别向容器A、气囊B中充入1molNO2,发生反应:2NO2(g)?N2O4(g).反应起始时A、B的体积均为1L.
我国于2016年10月17日在酒泉卫星发射中心由“长征二号”FY11运载火箭发射“神舟十一号”载人飞船.“长征二号”FY11运载火箭使用的氧化剂是N2O4.如图,A是由导热材料制成的恒容密闭容器,B是一耐化学腐蚀且易于传热的透明气囊.关闭K2,通过K1、K3分别向容器A、气囊B中充入1molNO2,发生反应:2NO2(g)?N2O4(g).反应起始时A、B的体积均为1L.分析 (1)反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量、浓度等不再发生变化;
(2)压强之比等于物质的量之比,计算平衡时混合气体物质的量,根据方程式计算反应的NO2的物质的量,再根据v=$\frac{△c}{△t}$计算v(NO2);
(3)平衡常数只与温度有关,若平衡后向A中再充入0.5molN2O4,等效为在原平衡基础上增大压强,平衡正向移动;
(4)打开开关K,保持温度不变,再达平衡时,等效为开始加入2molNO2到达的平衡,恒温恒压下与B中平衡为等效平衡,反应物转化率不变,平衡时混合气体总物质的量为B中2倍,恒温恒压下压强之比等于物质的量之比,则开始加入2molNO2到达的平衡时总体积为原平衡中气球B体积的2倍.
解答 解:(1)A.气体颜色不再改变,可说明物质的浓度不变,达到平衡状态,故A正确;
B.气体的平均摩尔质量不再改变,说明气体的物质的量不变,达到平衡状态,故B正确;
C.气体的质量不变,容器的体积不变,无论是否达到平衡状态,气体的密度都不改变,故C错误;
D.由于平衡常数位置,不能确定容器中n(N2O4):n(NO2)的值,故D错误.
故答案为:AB;
(2)压强之比等于物质的量之比,平衡时混合气体物质的量为1mol×0.8=0.8mol,则:
2NO2(g)?N2O4(g)
起始量(mol):1 0
转化量(mol):x 0.5x
平衡量(mol):1-x 0.5x
所以1-x+0.5x=0.8,解得x=0.4,
则v(NO2)=$\frac{\frac{0.4mol}{1L}}{2s}$=0.2mol/(L•s),
故答案为:0.2;
(3)平衡常数只与温度有关,温度不变,则平衡常数不变,若平衡后向A中再充入0.5molN2O4,等效为在原平衡基础上增大压强,平衡正向移动,重新到达平衡后,平衡混合气中NO2的体积分数减小,
故答案为:不变;变小;
(4)打开开关K,保持温度不变,再达平衡时,等效为开始加入2molNO2到达的平衡,恒温恒压下与B中平衡为等效平衡,反应物转化率不变,平衡时混合气体总物质的量为B中2倍,恒温恒压下压强之比等于物质的量之比,则开始加入2molNO2到达的平衡时总体积为原平衡中气球B体积的2倍,所以打开K2之前,气球B体积为(1L+0.2L)÷2=0.6L,
故答案为:0.6.
点评 本题考查化学平衡计算,为高频考点,涉及等效平衡问题,较好的考查学生分析解决问题能力,关键是等效平衡途径的建立,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
 “长征”火箭发射使用的燃料是偏二甲肼 (C2H8N2),并使用四氧化二氮作为氧化剂,这种组合的两大优点是,既能在短时间内产生巨大能量将火箭送上太空,产物又不污染空气(产物都是空气成分).某校外研究性学习小组拟将此原理设计为原电池,如图所示,结合学习过的电化学原理分析其设计方案,下列说法正确的是( )
“长征”火箭发射使用的燃料是偏二甲肼 (C2H8N2),并使用四氧化二氮作为氧化剂,这种组合的两大优点是,既能在短时间内产生巨大能量将火箭送上太空,产物又不污染空气(产物都是空气成分).某校外研究性学习小组拟将此原理设计为原电池,如图所示,结合学习过的电化学原理分析其设计方案,下列说法正确的是( )| A. | 从a口通入四氧化二氮气体 | |
| B. | 从d口排除的是NO气体 | |
| C. | H+由A流向B | |
| D. | A极发生的电极反应式:C2H8N2-16e-+8H2O=CO2+N2+16H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 向一容积为5L的恒容密闭容器内,充入0.2mol CO和0.4mol H2O,在一定条件下发生反应:CO(g)+H2O(g)?CO2(g)+H2 (g)△H>0.反应中CO2的浓度(c) 随时间(t)的变化关系如图所示.
向一容积为5L的恒容密闭容器内,充入0.2mol CO和0.4mol H2O,在一定条件下发生反应:CO(g)+H2O(g)?CO2(g)+H2 (g)△H>0.反应中CO2的浓度(c) 随时间(t)的变化关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,22.4 L CO2含有的分子数为NA | |
| B. | 1mol•L-1的Ba(OH)2溶液中含有的氢氧根离子数目为2NA | |
| C. | 常温常压下,18 g H2O含有的氢原子数为2NA | |
| D. | 1mol Fe在足量的Cl2中充分燃烧,转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
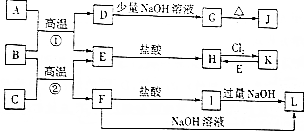
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀释Na2CO3溶液时,$\frac{c(HC{{O}_{3}}^{-}•c(O{H}^{-}))}{c(C{{O}_{3}}^{2-})}$增大 | |
| B. | 常温下,反应4Fe(OH)2(s)+2H2O(I)+O2(g)═4Fe(OH)3(s)的△H<0,△S<0 | |
| C. | 用0.1mol•L-1CH3COOH溶液滴定0.1mol•L-1 NaOH至中性时:c(Na+)=c(CH3COO-)+c(CH3COOH) | |
| D. | 向纯水中加入盐酸或氢氧化钠都能使水的电离平衡逆向移动,水的离子积减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将4gNaOH溶液溶入1L水中 | |
| B. | 常温下,将2.24LHCl气体溶于水配成1L溶液 | |
| C. | 含有4.9gH2SO4的溶液500mL | |
| D. | 将6.2gNa2O溶于水配成1L溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

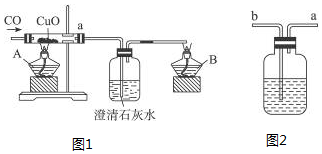
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com