
| A. | 常温常压下,22.4 L CO2含有的分子数为NA | |
| B. | 1mol•L-1的Ba(OH)2溶液中含有的氢氧根离子数目为2NA | |
| C. | 常温常压下,18 g H2O含有的氢原子数为2NA | |
| D. | 1mol Fe在足量的Cl2中充分燃烧,转移的电子数为2NA |
分析 A.常温常压下Vm>22.4L/mol;
B.依据n=CV判断;
C.依据n=$\frac{m}{M}$结合1个水分子含有2个H解答;
D.铁与氯气反应生成氯化铁,氯气足量,需要根据铁的量计算转移的电子数.
解答 解:A.常温常压下Vm>22.4L/mol,常温常压下,22.4 L CO2物质的量小于1mol,含有有的分子数小于NA,故A错误;
B.依据n=CV,溶液体积未知,无法计算氢氧化钡的物质的量,无法计算氢氧根离子个数,故B错误;
C.常温常压下,18 g H2O物质的量为$\frac{18g}{18g/mol}$=1mol,含有的氢原子数为2NA,故C正确;
D.1mol Fe在足量的Cl2中充分燃烧生成1mol氯化铁,转移的电子数为3NA,故D错误;
故选:C.
点评 本题考查阿伏加德罗常数的有关计算和判断,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系是解题关键,题目难度不大.


 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
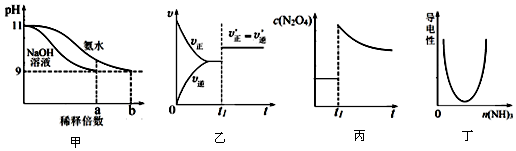
| A. | 图甲表示分别稀释pH=11的NaOH溶液和氨水时溶液pH的变化,图中b>a=100 | |
| B. | 图乙表示某化学平衡的移动,在t1时改变的条件一定是加入催化剂 | |
| C. | 图丙表示平衡2NO2(g)?N2O4(g)在t1时迅速将体积缩小后c(N2O4)的变化 | |
| D. | 图丁表示CH3COOH溶液中通入NH3至过量的过程中溶液导电性的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/min 浓度/mol•L-1 | 0 | 10 | 20 | 30 | 40 | 50 |
| H2(g) | 6.00 | 5.40 | 5.10 | 9.00 | 8.40 | 8.40 |
| CO2(g) | 2.00 | 1.80 | 1.70 | 3.00 | 2.80 | 2.80 |
| CH2=CH2(g) | 0 | 0.10 | 0.15 | 0.50 | 0.60 | 0.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 我国于2016年10月17日在酒泉卫星发射中心由“长征二号”FY11运载火箭发射“神舟十一号”载人飞船.“长征二号”FY11运载火箭使用的氧化剂是N2O4.如图,A是由导热材料制成的恒容密闭容器,B是一耐化学腐蚀且易于传热的透明气囊.关闭K2,通过K1、K3分别向容器A、气囊B中充入1molNO2,发生反应:2NO2(g)?N2O4(g).反应起始时A、B的体积均为1L.
我国于2016年10月17日在酒泉卫星发射中心由“长征二号”FY11运载火箭发射“神舟十一号”载人飞船.“长征二号”FY11运载火箭使用的氧化剂是N2O4.如图,A是由导热材料制成的恒容密闭容器,B是一耐化学腐蚀且易于传热的透明气囊.关闭K2,通过K1、K3分别向容器A、气囊B中充入1molNO2,发生反应:2NO2(g)?N2O4(g).反应起始时A、B的体积均为1L.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2L 1mol/L过氧化氢溶液中含氧原子数为4NA | |
| B. | 6.8g熔融的KHSO4中含有0.1NA个阳离子 | |
| C. | 2mol MnO2与足量的浓盐酸加热充分反应,转移电子数为4NA | |
| D. | 密闭容器中2molNO2和1molO2充分反应,产物分子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 .
.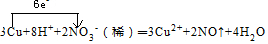 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com