
 在某容积一定的密闭容器中,可逆反应A(g)+B(g)?xC(g);△H<0,符合如图(I)所示关系,由此推断对图(II)的正确说法是( )
在某容积一定的密闭容器中,可逆反应A(g)+B(g)?xC(g);△H<0,符合如图(I)所示关系,由此推断对图(II)的正确说法是( )| A. | p3<p4,Y轴表示A的转化率 | |
| B. | p3>p4,Y轴表示混合气体的密度 | |
| C. | p3<p4,Y轴表示B的浓度 | |
| D. | p3>p4,Y轴表示混合气体的平均摩尔质量 |
分析 由图(1)可知,压强为P2时,温度T1先到达平衡,故温度T1>T2,且温度越高,平衡时C的质量分数越低,故升高温度平衡向逆反应移动,正反应为放热反应;
温度为T1时,压强P2先到达平衡,故压强P2>P1,且压强越大,平衡时C的质量分数越高,故增大压强平衡向正反应移动,正反应为体积减小的反应,故x=1,
由图(2)可知,升高温度,平衡向逆反应方向移动,y值减小,则y可为A、B的转化率、C的体积分数等,结合压强对平衡移动的影响分析.
解答 解:由图(1)可知,压强为P2时,温度T1先到达平衡,故温度T1>T2,且温度越高,平衡时C的质量分数越低,故升高温度平衡向逆反应移动,正反应为放热反应;
温度为T1时,压强P2先到达平衡,故压强P2>P1,且压强越大,平衡时C的质量分数越高,故增大压强平衡向正反应移动,正反应为体积减小的反应,故x=1,则:
A.如果p3<p4,在相同温度下增大压强平衡向正反应方向移动,则A的转化率增大,同时升高温度平衡向逆反应方向移动,A的转化率降低,图象与实际不符合,故A错误;
B.混合气体的总质量不变,容器的体积不变,混合气体的密度不变,故B错误;
C.P3<P4,增大压强,平衡向正反应移动,B的含量减小,同时升高温度平衡向逆反应方向移动,B的含量应增大,图象与实际不符,故C错误;
D.P3>P4,增大压强,平衡向正反应移动,混合气体总的物质的量减小,混合气体的总质量不变,平均相对分子质量增大,温度升高平衡向逆反应移动,混合气体总的物质的量增大,平均相对分子质量减小,图象与实际相符,故D正确;
故选D.
点评 本题考查化学平衡图象、化学平衡的影响因素等,难度中等,注意根据图(1)分析反应的特征是解题的关键.


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案科目:高中化学 来源: 题型:解答题
| 容器 | 甲 | 乙 | 丙 | |
| 起始反应物投入量 | 2molH2(g) 1molCO(g) | 1mol CH3OH(g) | 2mol CH3OH(g) | |
| 平衡 | c(CH3OH)/mol/•L-1 | c1 | c2 | c3 |
| 反应的能量变化/KJ | Q1 | Q2 | Q3 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | F-的原子结构示意图: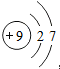 | B. | 乙烯的结构简式:CH2CH2 | ||
| C. | 葡萄糖的分子式:C6H12O6 | D. | 二氧化碳的电子式: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
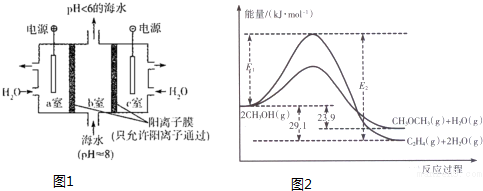
 甲醇被称为2l世纪的新型燃料,工业上通过下列反应①和②,用CH4和H2O为原料来制备甲醇.
甲醇被称为2l世纪的新型燃料,工业上通过下列反应①和②,用CH4和H2O为原料来制备甲醇.| 实验编号 | T(℃) | n (CO)/n(H2) | P(MPa) |
| I | 150 | 1/3 | 0.1 |
| II | 5 | ||
| III | 350 | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
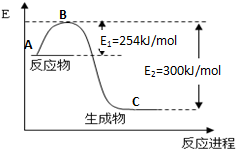 到目前为止,由化学能转变的热能或电能仍然是人类使用最广泛的能源.
到目前为止,由化学能转变的热能或电能仍然是人类使用最广泛的能源.| 化学键 | H-H | N≡N |
| 键能(kJ/mol) | 435 | 943 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H>0,△S>0的反应在所有温度下都能自发进行 | |
| B. | NH4HCO3(s)=NH3 (g)+H2O(g)+CO2(g)△H=+185.57 kJ•mol-1能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 | |
| C. | △H<0、△S>0的反应在任何温度下都能自发进行 | |
| D. | 在其他外界条件不变的情况下,使用催化剂,可以改变化学反应速率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com