
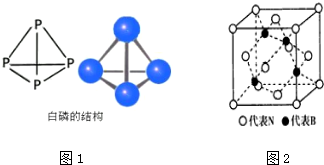
���� ��1��Pԭ�Ӻ�����15�����ӣ����ݹ���ԭ����д��̬Pԭ�Ӻ�������Ų�ʽ��
��2��N4������ÿ��Nԭ�Ӽ۲���ӶԸ�����4�Һ���һ���µ��Ӷԣ����ݼ۲���ӶԻ��������ж�Nԭ���ӻ���ʽ���÷��ӽṹ�Ͱ����ӽṹ��ͬ��Ϊ��������ṹ��
��3��ͬһ����Ԫ�أ�Ԫ�ص�һ����������ԭ�������������С��
��4��ͬһ�ǽ���Ԫ���γɵĺ������У����ǻ�Oԭ�Ӹ���Խ���������Խǿ����������з��ǻ���ԭ�Ӹ������������ᣬ�����������Խ�ǿ������������йµ��ӶԸ���=$\frac{5+1-3��2}{2}$=0��������������йµ��ӶԸ���=$\frac{5+1-2��2}{2}$=1������������Ӽ۲���ӶԸ���=2+$\frac{5+1-2��2}{2}$=3��
��5�������黯�ؾ�����������������ṹ���ƣ�������ԭ�Ӿ��壬ԭ�Ӱ뾶ԽС�����ۼ�Խǿ�������۵�Խ�ߣ����ݾ�̯�����㾧����As��Gaԭ����Ŀ����ʾ���������������ݦ�=$\frac{m}{V}$���㾧���ܶȣ�
��� �⣺��1��Pԭ�Ӻ�����15�����ӣ����ݹ���ԭ����д��̬Pԭ�Ӻ�������Ų�ʽΪ1s22s22p63s23p3��
�ʴ�Ϊ��1s22s22p63s23p3��
��2��N4������ÿ��Nԭ�Ӽ۲���ӶԸ�����4�Һ���һ���µ��Ӷԣ����ݼ۲���ӶԻ��������ж�Nԭ���ӻ���ʽΪsp3���÷��ӽṹ�Ͱ����ӽṹ��ͬ��Ϊ��������ṹ������Ϊ60�㣬
�ʴ�Ϊ��sp3��60�㣻
��3��ͬ�������϶��µ�һ�����ܼ�С���ʵ�һ�����ܣ�N��P��As��
�ʴ�Ϊ��N��P��As��
��4��ͬһ�ǽ���Ԫ���γɵĺ������У����ǻ�Oԭ�Ӹ���Խ���������Խǿ����������з��ǻ���ԭ�Ӹ������������ᣬ�����������Խ�ǿ��NO3-�йµ��ӶԸ���=$\frac{5+1-3��2}{2}$=0��������������йµ��ӶԸ���=$\frac{5+1-2��2}{2}$=1������������Ӽ۲���ӶԸ���=2+$\frac{5+1-2��2}{2}$=3��NO2-�۵��ӹ�����ƽ�������Σ�
�ʴ�Ϊ��HNO3��NO3-��ƽ�������Σ�
��5�������黯�ؾ�����������������ṹ���ƣ�������ԭ�Ӿ��壬ԭ�Ӱ뾶N��As��B��Ga���ʵ������й��ۼ���ǿ��������ľ����۵���ߣ�������As��Gaԭ����Ŀ��Ϊ4����������Ϊ4��$\frac{145}{{N}_{A}}$g�������ܶ�Ϊ4��$\frac{145}{{N}_{A}}$g�£�a��10-10 cm��3=$\frac{5.8��1{0}^{32}}{{N}_{A}��{a}^{3}}$g��cm-3��
�ʴ�Ϊ��������$\frac{5.8��1{0}^{32}}{{N}_{A}��{a}^{3}}$��
���� �����Ƕ����ʽṹ�����ʵĿ��飬�漰��������Ų����ӻ���ʽ�жϡ������ܡ������ṹ����㡢�۷е�Ƚϵȣ���5��Ϊ�״��㡢�ѵ㣬��Ҫѧ���߱�һ���Ŀռ�������Ŀ�Ѷ��еȣ�


 �żӾ���ϵ�д�
�żӾ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ��ѧ�� | H-H | C-O | C��O | H-O | C-H |
| ����/kJ��mol-1 | a | b | x | c | d |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
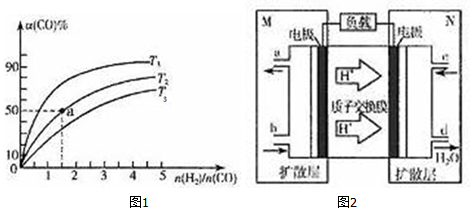
 ��ij�ݻ�һ�����ܱ������У����淴ӦA��g��+B��g��?xC��g������H��0��������ͼ��I����ʾ��ϵ���ɴ��ƶ϶�ͼ��II������ȷ˵���ǣ�������
��ij�ݻ�һ�����ܱ������У����淴ӦA��g��+B��g��?xC��g������H��0��������ͼ��I����ʾ��ϵ���ɴ��ƶ϶�ͼ��II������ȷ˵���ǣ�������| A�� | p3��p4��Y���ʾA��ת���� | |
| B�� | p3��p4��Y���ʾ���������ܶ� | |
| C�� | p3��p4��Y���ʾB��Ũ�� | |
| D�� | p3��p4��Y���ʾ��������ƽ��Ħ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 32gO2��32gO3����ԭ����Ŀ��Ϊ2NA | |
| B�� | ��״���£�11.2 Lˮ�к��е�ԭ������1.5NA | |
| C�� | 0.1 mol Fe���뻯ѧ��Ӧת�Ƶĵ�����һ��Ϊ0.3NA | |
| D�� | ��ͬ��ͬѹ�£���ͬ������κ����嵥��������ԭ������� |
�鿴�𰸺ͽ���>>
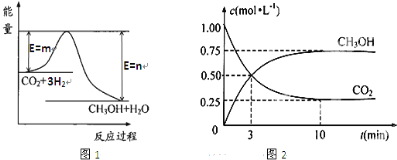
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 84% | B�� | 24% | C�� | 19.6% | D�� | 42% |
�鿴�𰸺ͽ���>>
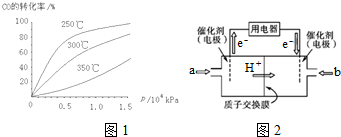
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����������ȷֽ�ʱ����ȼ������������ | |
| B�� | ���������ֽ����ɵ�ˮ����ϡ��ȼ������������ | |
| C�� | �����������ȷֽ���������ʹ��ȼ����Ż�㽵�� | |
| D�� | ���������ֽ����ɵ�������������ȼ������棬ʹȼ������O2���� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com