
【题目】某研究小组利用氮气、氧化铝和活性炭制取氮化铝,设计如图1所示实验装置。
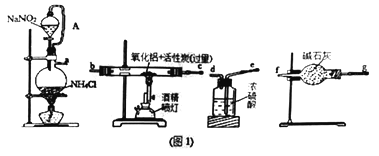
请回答:
(1)图1中用饱和NaNO2溶液与NH4Cl溶液加热制取氮气,该离子方程式为____________________。
(2)按要求连接好实验装置后,接下来首先进行的操作是______________________________。
(3)导管A的作用是_______________________________。
(4)图1装置中各仪器导管口连接的顺序是(可重复使用,用小写字母a→f填写):____
(5)反应结束后,某同学用图2装置进行实验来测定氮化铝样品的质量分数(实验中导管体积忽略不计)。
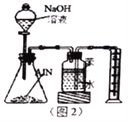
①氮化铝与过量的NaOH溶液反应生成氮气化学反应方程式为__________________________。
②集气瓶中的苯的作用是_________________________;集气瓶中的液体没有装满,则实验测得NH3的体积将___________________________(填“偏大”“偏 小”或“不变”)。
③若实验中称取氮化铝样品的质量为8.2g,测得氨气的体积2.8L(标准状况),则样品中AlN的质量分数为____________________(保留3位有效数字)
【答案】 NO2-+NH4+![]() 2H2O+N2↑ 检查装置的气密性 平衡分液漏斗与烧瓶之间的压强,使NaNO2饱和溶液顺利滴下 a-e-d-g-f-c-b(或b-c) -g-f AlN+NaOH+H2O===NaAlO2+NH3↑ 防止氨气溶于水 不变 62.5%
2H2O+N2↑ 检查装置的气密性 平衡分液漏斗与烧瓶之间的压强,使NaNO2饱和溶液顺利滴下 a-e-d-g-f-c-b(或b-c) -g-f AlN+NaOH+H2O===NaAlO2+NH3↑ 防止氨气溶于水 不变 62.5%
【解析】(1)图1中用饱和NaNO2溶液与NH4Cl溶液加热制取氮气,化学方程式为:NaNO2+NH4Cl![]() NaCl+2H2O+N2↑,反应的离子方程式为NO2-+NH4+
NaCl+2H2O+N2↑,反应的离子方程式为NO2-+NH4+![]() 2H2O+N2↑,故答案为:NO2-+NH4+
2H2O+N2↑,故答案为:NO2-+NH4+![]() 2H2O+N2↑;
2H2O+N2↑;
(2)有气体的实验装置要检查装置气密性;故答案为:检查装置的气密性;
(3)导管A的作用是平衡分液漏斗与烧瓶之间的压强,使NaNO2饱和溶液顺利滴下,故答案为:平衡分液漏斗与烧瓶之间的压强,使NaNO2饱和溶液顺利滴下;
(4)用饱和NaNO2溶液与NH4Cl溶液加热制取氮气与氧化铝反应,因氮化铝易水解,故流程中应注意无水,则氮气从a经浓硫酸干燥,为干燥充分,导管长进短出,连接e、d,为干燥充分,可再连接一个干燥管,gf,在玻璃管中反应,故连接bc,为防止空气中的水蒸气进入装置,最后连接一个干燥管gf,故答案为:a-e-d-g-c(或b)c(或b)-g-f或a-e-d-g-f--b(或c)-c(或b)-g-f;
(5)①氮化铝与过量的NaOH溶液反应生成氨气化学反应方程式为:AlN+NaOH+H2O═NaAlO2+NH3↑;故答案为:AlN+NaOH+H2O═NaAlO2+NH3↑;
②因为氨气极易溶于水,所以广口瓶的水面上应加一层苯,来将气体和水隔绝,广口瓶中的气压之所以会增大,是因为有氨气进入,所以无论广口瓶中是否有空气,进入瓶中氨气的体积都等于排进量筒中水的体积,所以不受影响;故答案为:防止氨气溶于水;不变;
③氨气的体积为2.8L(标准状况),则n(氨气)= ![]() =0.125mol,所以氮化铝的物质的量是0.125mol,质量是0.125mol×41g/mol=5.125g,所以氮化铝的质量分数为
=0.125mol,所以氮化铝的物质的量是0.125mol,质量是0.125mol×41g/mol=5.125g,所以氮化铝的质量分数为![]() ×100%=62.5%;故答案为:62.5%。
×100%=62.5%;故答案为:62.5%。


科目:高中化学 来源: 题型:
【题目】PbO(溶于酸,微溶于强碱溶液)在工业上用途广泛,可制作颜料铅白、杀虫剂等。某再生能源企业以含铅废料(主要含Pb、PbO、PbSO4和极少量的PbO2)和稀H2SO4为原料制备高纯PbO的工艺流程如下:

(1)含铅废料中的PbO2和PbSO4中,铅的化合价分别为____________、____________。
(2)酸溶过程中为了加快溶解速率,除了加入FeSO4作催化剂外,还可采取的措施有____________________(任写一种)。
(3)滤液A中含有的主要阳离子是____________________(填离子符号)。
(4)脱硫过程发生的主要反应的离子方程式为________________________________。
(5)冷却、过滤后对所得的固体进行洗涤操作,在实验室洗涤时,所用到的玻璃仪器有烧杯、_________和_________,检验沉淀是否洗涤干净的方法是________________________________。
(6)PbO溶解在NaOH溶液中,存在平衡:PbO(s)+NaOH(aq)![]() NaHPbO2(aq)。PbO的溶解度曲线如图所示。结合该曲线,简述由粗品PbO得到高纯PbO的操作:_______________________________。
NaHPbO2(aq)。PbO的溶解度曲线如图所示。结合该曲线,简述由粗品PbO得到高纯PbO的操作:_______________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组用下图所示装置对Cl2与Na2S2O3溶液的反应进行探究(气密性已检验)。
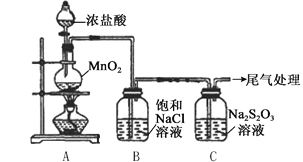
实验操作和现象:
操作 | 现象 |
打开分液漏斗活塞,滴加一定量浓盐酸,加热 | i. A中有黄绿色气体生成,C中液面上方有白雾,溶液中开始出现少量浑浊; ii. 一段时间后,C中产生大量黄色沉淀。 |
用湿润的淀粉碘化钾试纸检验C中白雾 | 淀粉碘化钾试纸变蓝 |
C中浊液过滤后,取少量滤液用盐酸酸化,滴加氯化钡溶液 | 有白色沉淀生成 |
查阅资料:a. S2O32-有较强的还原性
b. 酸性条件下S2O32-迅速分解为S和SO2
(1)A中发生反应的离子方程式是__________。
(2)B中饱和NaCl溶液的作用是_______。
(3)C中生成黄色沉淀的离子方程式是__________。
(4)为检验C中是否有SO2生成,需进行的操作是_______。
(5)C中滤液与氯化钡溶液反应生成白色沉淀,甲同学认为利用该现象可证明Na2S2O3被Cl2氧化,反应的离子方程式是__________。
(6)乙同学认为,C中滤液用硝酸酸化后滴加硝酸银溶液,若有白色沉淀,也能证明Na2S2O3被Cl2氧化,丙同学认为不能证明,理由是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从理论上分析,关于Fe﹣CuSO4溶液﹣Cu原电池的叙述正确的是( )
A.铜极为负极
B.电子从铜沿导线转移到铁
C.铁表面析出金属铜
D.总反应为Fe+CuSO4=FeSO4+Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究.其结构简式如图.下列关于分枝酸的叙述正确的是
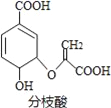
A. 分子中含有2种官能团
B. 可与乙醇、乙酸反应,且反应类型相同
C. 1mol分枝酸最多可与3molNaOH发生中和反应
D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物分子中,当某个碳原子连接着四个不同的原子或原子团时,这种碳原子称为“手性碳原子”。例如,如图有机物分子中带“*”碳原子就是手性碳原子。该有机物分别发生下列应,生成的有机物分子中仍含有手性碳原子的是
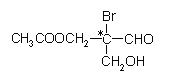
A. 催化剂作用下与H2反应
B. 与NaOH水溶液反应
C. 发生银镜反应
D. 与乙酸发生酯化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列液体中,出现丁达尔效应的分散系是( )
①早晨树林里的雾 ②牛奶 ③豆浆 ④H2SO4溶液 ⑤硫酸铜溶液
A.①②③B.②③④C.③④⑤D.全部
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com