
����Ŀ��ijС������ͼ��ʾװ�ö�Cl2��Na2S2O3��Һ�ķ�Ӧ����̽�����������Ѽ��飩��
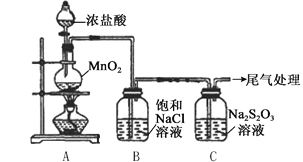
ʵ�����������
���� | ���� |
��Һ©���������μ�һ����Ũ���ᣬ���� | i. A���л���ɫ�������ɣ�C��Һ���Ϸ��а�������Һ�п�ʼ�����������ǣ� ii. һ��ʱ���C�в���������ɫ������ |
��ʪ��ĵ��۵⻯����ֽ����C�а��� | ���۵⻯����ֽ���� |
C����Һ���˺�ȡ������Һ�������ữ���μ��Ȼ�����Һ | �а�ɫ�������� |
�������ϣ�a. S2O32-�н�ǿ�Ļ�ԭ��
b. ����������S2O32-Ѹ�ٷֽ�ΪS��SO2
��1��A�з�����Ӧ�����ӷ���ʽ��__________��
��2��B�б���NaCl��Һ��������_______��
��3��C�����ɻ�ɫ���������ӷ���ʽ��__________��
��4��Ϊ����C���Ƿ���SO2���ɣ�����еIJ�����_______��
��5��C����Һ���Ȼ�����Һ��Ӧ���ɰ�ɫ��������ͬѧ��Ϊ���ø������֤��Na2S2O3��Cl2��������Ӧ�����ӷ���ʽ��__________��
��6����ͬѧ��Ϊ��C����Һ�������ữ��μ���������Һ�����а�ɫ������Ҳ��֤��Na2S2O3��Cl2��������ͬѧ��Ϊ����֤����������__________��
���𰸡� MnO2+4H++2Cl-![]() Mn2++C12��+2H2O ��ȥCl2�е�HCl����ֹ��Cl2��Na2S2O3�ķ�Ӧ�������� S2O32-+2H+��S+SO2��+H2O �Ѱ���ͨ��Ba��NO3��2��Һ�У����а�ɫ������֤����SO2���� S2O32-+4Cl2+5H2O��8Cl-+2SO42-+10H+ ������ˮ��ӦҲ������Cl-�����Լ������Һ����Cl-Ҳ����֤����Cl2������Na2S2O3
Mn2++C12��+2H2O ��ȥCl2�е�HCl����ֹ��Cl2��Na2S2O3�ķ�Ӧ�������� S2O32-+2H+��S+SO2��+H2O �Ѱ���ͨ��Ba��NO3��2��Һ�У����а�ɫ������֤����SO2���� S2O32-+4Cl2+5H2O��8Cl-+2SO42-+10H+ ������ˮ��ӦҲ������Cl-�����Լ������Һ����Cl-Ҳ����֤����Cl2������Na2S2O3
�������������������1��A�ж������̺�Ũ�����ڼ���������Ӧ���ɶ��Ȼ��̡�������ˮ��������Ӧ�����ӷ���ʽ��MnO2+4H+ +2Cl��![]() Mn2++Cl2 ��+2H2O����2��������Ϣb������������S2O32��Ѹ�ٷֽ�ΪS��SO2֪B�б���NaCl��Һ�������dz�ȥCl2�е�HCl����ֹ��Cl2��Na2S2O3�ķ�Ӧ�������š���3��C�����ɻ�ɫ���������ӷ���ʽ��S2O32�� + 2H+====S�� + SO2 ��+H2O����4��Ϊ����C���Ƿ���SO2���ɣ�������SO2�Ļ�ԭ�Խ��м��飬����еIJ����ǰѰ���ͨ��Ba(NO3)2��Һ�У����а�ɫ������֤����SO2 ���ɡ���5��S2O32���н�ǿ�Ļ�ԭ�ԣ�ˮ��Һ��S2O32����Cl2���������������Cl2����ԭ�������ӣ���Ӧ�����ӷ���ʽ��S2O32�� +4Cl2+5H2O====8Cl��+2SO42-+10H+����6��C����Һ�������ữ��μ���������Һ�����а�ɫ����������֤��Na2S2O3��Cl2������������������ˮ��ӦҲ������Cl�������Լ������Һ����Cl��Ҳ����֤����Cl2������Na2S2O3��
Mn2++Cl2 ��+2H2O����2��������Ϣb������������S2O32��Ѹ�ٷֽ�ΪS��SO2֪B�б���NaCl��Һ�������dz�ȥCl2�е�HCl����ֹ��Cl2��Na2S2O3�ķ�Ӧ�������š���3��C�����ɻ�ɫ���������ӷ���ʽ��S2O32�� + 2H+====S�� + SO2 ��+H2O����4��Ϊ����C���Ƿ���SO2���ɣ�������SO2�Ļ�ԭ�Խ��м��飬����еIJ����ǰѰ���ͨ��Ba(NO3)2��Һ�У����а�ɫ������֤����SO2 ���ɡ���5��S2O32���н�ǿ�Ļ�ԭ�ԣ�ˮ��Һ��S2O32����Cl2���������������Cl2����ԭ�������ӣ���Ӧ�����ӷ���ʽ��S2O32�� +4Cl2+5H2O====8Cl��+2SO42-+10H+����6��C����Һ�������ữ��μ���������Һ�����а�ɫ����������֤��Na2S2O3��Cl2������������������ˮ��ӦҲ������Cl�������Լ������Һ����Cl��Ҳ����֤����Cl2������Na2S2O3��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�±����ݣ�
���� | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
Ksp/25 �� | 8.0��10��16 | 2.2��10��20 | 4.0��10��36 |
��ȫ����ʱ��pH��Χ | ��9.6 | ��6.4 | ��3 |
�Ժ������ʵ�����CuSO4��FeSO4��Fe2(SO4)3�Ļ����Һ������˵������ȷ���ǣ� ��
A. ��û����Һ����μ���NaOH��Һ�����ȿ���������ɫ����
B. ����Һ��c(SO42-)��[c(Cu2��)��c(Fe2��)��c(Fe3��)]��5��4
C. �����Һ�м���������ˮ������pH��4��5����ˣ��ɻ�ô�����CuSO4��Һ
D. �����Һ�м���������ˮ������pH��9.6����ˣ������ó������գ��ɵõ����ʵ�����CuO��FeO��Fe2O3���ֹ���Ļ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й�����������У���ȷ���� ( )
A.��ֻ�Ի���̬��������Ȼ����B.����һ�ֻ�ɫ��������ˮ�ľ���
C.���ڿ�����ȼ�����ɶ�������D.���ڹ���������ȼ��������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ϡ����Ϊ�������Һ��ͭ����пԭ����У���֪��缫��Ӧ�ֱ�ΪпƬ��Zn��2e��=Zn2+��ͭƬ��2H++2e��=H2���������ж���ȷ���ǣ� ��
A.��Һ����������ǿ
B.ͭƬ���ܽ�
C.��Һ��H+��пƬ�������ƶ�
D.пƬ�Ǹ�����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ��ʵ��������ͼ��ʾ��������ҩƷ������������ͭ�۷�Ӧ��ʵ�飨���ּг�װ����ʡ�ԣ����밴Ҫ��ش��������⣺
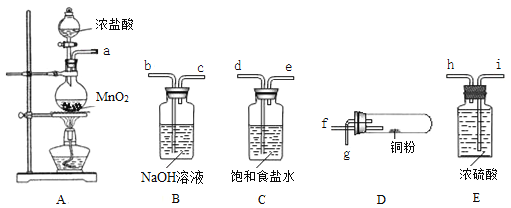
��1��װ��A��ƿ�з�����Ӧ�Ļ�ѧ����ʽΪ_____________________________________��
��2���������������Ӹ������ӿڵ�˳���ǣ���ӿ���ĸ����
a��______________________��
��3��װ��B�з�����Ӧ�����ӷ���ʽΪ________________________��װ��C�б���ʳ��ˮ��������__________________________________��
��4������װ��Dʱ��ͭ�۷�����Ӧ�Ļ�ѧ����ʽΪ____________________________��
��5���Ƚ���������ʵ�飬����Ϊ����˵����ȷ����_____������ţ���
ʵ��٣��������Ķ��������뺬0.4molHCl��Ũ���ᷴӦ��
ʵ��ڣ���8.7g����������������Ũ���ᷴӦ��
A���ٲ����������� B������������һ����
C���ڲ����������� D�����ж�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ������װ���Ʊ�������Cl2�����ʡ�����˵���������
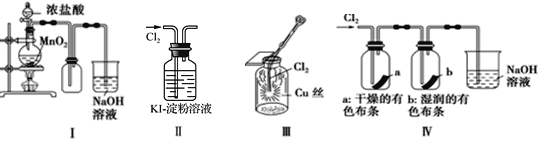
A. ��ͼ�У����MnO2������Ũ����Ϳ�ȫ��������
B. ��ͼ�У���Һ����
C. ��ͼ�У������ػ�ɫ����
D. ��ͼ�У��������ɫ��������ɫ��ʪ�����ɫ������ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. �������뱽��������KMnO4��Һ����
B. ��һ�������£�����Һ�塢���ᡢ�������������屽����������������ķ�Ӧ������ȡ����Ӧ
C. ����ʽΪC8H10O��ij���㻯�����ж��ֽṹ�����к���-CH2OH���ŵ���4��
D. �������![]() ����̼ԭ�ӿ��ܶ�����ͬһƽ��
����̼ԭ�ӿ��ܶ�����ͬһƽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о�С�����õ������������ͻ���̿��ȡ�������������ͼ1��ʾʵ��װ�á�
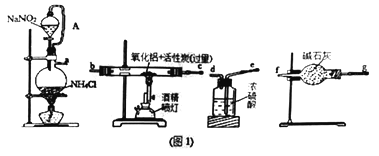
��ش�
��1��ͼ1���ñ���NaNO2��Һ��NH4Cl��Һ������ȡ�����������ӷ���ʽΪ____________________��
��2����Ҫ�����Ӻ�ʵ��װ�ú��������Ƚ��еIJ�����______________________________��
��3������A��������_______________________________��
��4��ͼ1װ���и��������ܿ����ӵ�˳���ǣ����ظ�ʹ�ã���Сд��ĸa��f��д����____
��5����Ӧ������ijͬѧ��ͼ2װ�ý���ʵ�����ⶨ��������Ʒ������������ʵ���е���������Բ��ƣ���
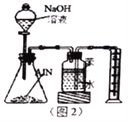
�ٵ������������NaOH��Һ��Ӧ���ɵ�����ѧ��Ӧ����ʽΪ__________________________��
�ڼ���ƿ�еı���������_________________________������ƿ�е�Һ��û��װ������ʵ����NH3�������___________________________���ƫ��ƫ С�����䡱����
����ʵ���г�ȡ��������Ʒ������Ϊ8.2g����ð��������2.8L����״����������Ʒ��AlN����������Ϊ____________________������3λ��Ч���֣�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I. Ϊ���ε�ȱ������ͨ����ʳ�������������ĵ����(KIO3)������غ͵⻯������Һ���ܷ������з�Ӧ�� KIO3��5KI��3H2SO4 = 3I2��3K2SO4��3H2O
(1)�÷�Ӧ�У���������________������������________��
(3)����1.5 mol I2����ʱ����________mol��ԭ����������
(4)����4 mol���������뷴Ӧʱ��ת�Ƶ�����Ϊ________ ����
II. �ܽ����ڸ�������ɡ��г���������Ž������꣬�Ż���ͭ���������е���ͭ��������ͭ�⣬���Ļ�ѧ�ɷ���Cu2(OH)2CO3����ʽ̼��ͭ����ͭ�ڳ�ʪ�Ŀ���������Ļ�ѧ��ӦΪ��2Cu+O2+CO2+H2O = Cu2(OH)2CO3��
(1)�÷�Ӧ�еĻ�ԭ����_________��
(2)���ͭ�����ѡ����Լ���_____________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com