
【题目】某同学在实验室以下图所示的仪器和药品,进行氯气和铜粉反应的实验(部分夹持装置已省略)。请按要求回答下列问题:
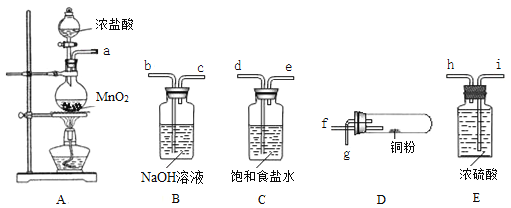
(1)装置A烧瓶中发生反应的化学方程式为_____________________________________。
(2)按气流方向连接各仪器接口的顺序是(填接口字母):
a→______________________。
(3)装置B中发生反应的离子方程式为________________________,装置C中饱和食盐水的作用是__________________________________。
(4)加热装置D时,铜粉发生反应的化学方程式为____________________________。
(5)比较下列两组实验,你认为下列说法正确的是_____(填序号)。
实验①:将足量的二氧化锰与含0.4molHCl的浓盐酸反应。
实验②:将8.7g二氧化锰与足量的浓盐酸反应。
A.①产生的氯气多 B.产生的氯气一样多
C.②产生的氯气多 D.无法判断
【答案】MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O d e i h f g b Cl2+2OH﹣═Cl﹣+ClO﹣+H2O 除去氯化氢,减小氯气的溶解性 Cl2+Cu
MnCl2+Cl2↑+2H2O d e i h f g b Cl2+2OH﹣═Cl﹣+ClO﹣+H2O 除去氯化氢,减小氯气的溶解性 Cl2+Cu![]() CuCl2 C
CuCl2 C
【解析】
氯气和铜粉反应的实验:MnO2与浓盐酸制取的Cl2含有HCl和H2O,用饱和食盐水除去HCl,用浓硫酸除去H2O,然后Cl2与Cu反应,最后用NaOH溶液吸收未反应的Cl2,防止污染空气;二氧化锰与浓盐酸反应生成氯气,随反应进行浓盐酸变为稀盐酸,二氧化锰不与稀盐酸反应,对于实验①,将足量的二氧化锰与含HCl0.4mol浓盐酸反应产生的氯气,HCl不能完全反应,假定HCl完全反应,计算生成的氯气的物质的量,实际氯气小于该值,对于实验②,将0.1mol二氧化锰与足量的浓盐酸反应产生的氯气,二氧化锰完全反应,根据二氧化锰结合方程式计算生成的氯气的物质的量。
(1)装置A中制取氯气,二氧化锰与浓盐酸发生反应生成氯化锰、氯气、水,反应方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,故答案为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,故答案为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(2)按照气体流向由左到右,仪器连接顺序为Cl2发生装置→除去HCl气体装置→干燥装置→制备装置→多余Cl2处理装置,MnO2与浓盐酸制取的Cl2含有HCl和H2O,用饱和食盐水除去HCl,用浓硫酸除去H2O,然后Cl2与Cu反应,最后用NaOH溶液吸收未反应的Cl2,防止污染空气,所以按气流方向各仪器接口顺序是:a→d→e→i→h→f→g→b,故答案为:d→e→i→h→f→g→b;
(3)装置B中为氢氧化钠吸收氯气生成氯化钠和次氯酸钠的反应,离子方程式为:Cl2+2OH-═Cl-+ClO-+H2O,故答案为:Cl2+2OH-═Cl-+ClO-+H2O;
装置C中饱和食盐水的作用是除去氯化氢,减小氯气的溶解性,故答案为:除去氯化氢,减小氯气的溶解性;
(4)加热时Cu与Cl2发生化合反应生成CuCl2,反应的化学方程式为Cu+Cl2![]() CuCl2;故答案为:Cu+Cl2
CuCl2;故答案为:Cu+Cl2![]() CuCl2
CuCl2
(5)对于实验①,将足量的二氧化锰与含HCl0.4mol浓盐酸反应产生的氯气,HCl不能完全反应,假定HCl完全反应,根据反应方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O可知,含HCl0.4mol浓盐酸完全反应生成氯气为0.4mol×1/4=0.1mol,实际氯气小于0.1mol;对于实验②,将0.1mol二氧化锰与足量的浓盐酸反应产生的氯气,二氧化锰完全反应,根据反应方程式可知,生成氯气为0.1mol,实验②生成的氯气大于实验①生成的氯气,故选C,故答案为:C。
MnCl2+Cl2↑+2H2O可知,含HCl0.4mol浓盐酸完全反应生成氯气为0.4mol×1/4=0.1mol,实际氯气小于0.1mol;对于实验②,将0.1mol二氧化锰与足量的浓盐酸反应产生的氯气,二氧化锰完全反应,根据反应方程式可知,生成氯气为0.1mol,实验②生成的氯气大于实验①生成的氯气,故选C,故答案为:C。


 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:
【题目】工业废料和废水的处理离不开化学。
I. 某工业废料含SiO2、FeS和CuS等物质,采用如下实验方案进行回收利用。请回答下列问题:
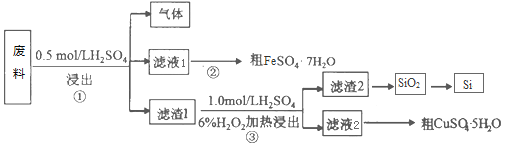
(1)已知步骤①中发生的化学反应为非氧化还原反应,写出产生气体的电子式_______,该气体可用足量的NaOH溶液吸收,该反应的离子方程式是_______________________________
(2)Si原子在周期表中的位置____________,写出晶体Si的一种主要用途___________。步骤②的操作依次为____________________、过滤、洗涤、干燥。滤渣2的主要成分是SiO2和S,写出步骤③涉及的化学方程式_________________________________。
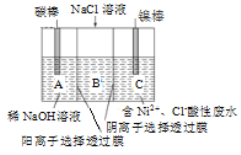
II.用一种阴、阳离子双隔膜三室电解槽处理含镍酸性废水并获得金属镍的模拟装置如图。
镍棒与外接电源____极相连。A极区电极反应式是__________________________。 电解一段时间后,B中NaCl溶液的浓度_________填“增大”、“减少”);若将图中阳离子膜去掉,将A、B两室合并,则A极区电极产物是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.分子晶体中一定存在分子间作用力和共价键
B.HF比HCl沸点高是因为HF分子间存在氢键
C.全部由非金属元素形成的化合物中可能含有离子键
D.溶于水能导电的化合物一定是离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(AlN,Al和N的相对原子质量分别为27和14)广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应Al2O3+N2+3C![]() 2AlN+3CO合成。下列叙述不正确的是
2AlN+3CO合成。下列叙述不正确的是
A. 上述反应中, C是还原剂,AlN是还原产物
B. 上述反应中,每生成1 mol AlN需转移3 mol电子
C. AlN中氮元素的化合价为-3
D. AlN的摩尔质量为41
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素R的阳离子是RN+ , 核外共有x个电子,其质量数为A,则R核内中子数为( )
A.A﹣X+N
B.A﹣X﹣N
C.A+X+N
D.A﹣N+X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组用下图所示装置对Cl2与Na2S2O3溶液的反应进行探究(气密性已检验)。
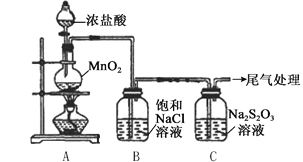
实验操作和现象:
操作 | 现象 |
打开分液漏斗活塞,滴加一定量浓盐酸,加热 | i. A中有黄绿色气体生成,C中液面上方有白雾,溶液中开始出现少量浑浊; ii. 一段时间后,C中产生大量黄色沉淀。 |
用湿润的淀粉碘化钾试纸检验C中白雾 | 淀粉碘化钾试纸变蓝 |
C中浊液过滤后,取少量滤液用盐酸酸化,滴加氯化钡溶液 | 有白色沉淀生成 |
查阅资料:a. S2O32-有较强的还原性
b. 酸性条件下S2O32-迅速分解为S和SO2
(1)A中发生反应的离子方程式是__________。
(2)B中饱和NaCl溶液的作用是_______。
(3)C中生成黄色沉淀的离子方程式是__________。
(4)为检验C中是否有SO2生成,需进行的操作是_______。
(5)C中滤液与氯化钡溶液反应生成白色沉淀,甲同学认为利用该现象可证明Na2S2O3被Cl2氧化,反应的离子方程式是__________。
(6)乙同学认为,C中滤液用硝酸酸化后滴加硝酸银溶液,若有白色沉淀,也能证明Na2S2O3被Cl2氧化,丙同学认为不能证明,理由是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于氯水性质的描述中不正确的是
A. 观察氯水的颜色,发现氯水呈黄绿色,说明氯水中存在Cl2
B. 向氯水中滴入碳酸钠溶液,有气体生成,说明氯水中存在H+
C. 向氯水中滴加硝酸银溶液,有白色沉淀生成,说明氯水中存在Cl-
D. 氯水经光照后,颜色逐渐消失并放出气体,导致溶液的酸性减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究.其结构简式如图.下列关于分枝酸的叙述正确的是
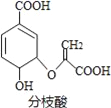
A. 分子中含有2种官能团
B. 可与乙醇、乙酸反应,且反应类型相同
C. 1mol分枝酸最多可与3molNaOH发生中和反应
D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应伴随着能量的变化.下列过程中的能量变化不是由化学反应引起的是( )
A.天然气燃烧
B.中和反应
C.冰的融化
D.Ba(OH)28H2O晶体与NH4Cl晶体反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com