
| A.同主族元素从上到下,元素原子得电子能力逐渐减弱,氢化物的稳定性逐渐增强 |
| B.除稀有气体元素外,第三周期元素的原子半径不一定比第二周期元素的原子半径大 |
| C.化学反应的过程中一定伴随着热量的变化 |
| D.在主族元素中,最外层电子数少的元素原子一定比最外层电子数多的元素原子失电子能力强高 |
 口算能手系列答案
口算能手系列答案科目:高中化学 来源:不详 题型:单选题
| A.无3d、4s轨道,无所谓能量高低 | B.3d>4s | C.3d=4s | D.3d<4s |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
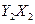 分子中Y原子轨道的杂化类型为 ,1mol
分子中Y原子轨道的杂化类型为 ,1mol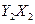 含有
含有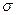 键的数目为 。
键的数目为 。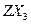 的沸点比化合物
的沸点比化合物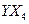 的高,其主要原因是
的高,其主要原因是  。
。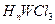 ,反应的化学方程式为 。
,反应的化学方程式为 。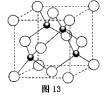
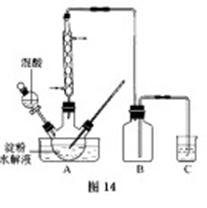
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.13153I和12753I都含有55个中子 |
| B.13153I和12753互为同位素 |
| C.13153I和12753I的核外电子数不同 |
| D.13153I和12753I分别含有131和127个质子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.晶体熔点由低到高:CF4<CCl4<CBr4<CI4 |
| B.硬度由大到小:金刚石>碳化硅>晶体硅 |
| C.热稳定性:HI>HBr>HCl>HF |
| D.晶格能由大到小: NaF> NaCl> NaBr>NaI |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 粒子代码 | X | Y | Z |
| 原子核数 | 单核 | 两核 | 四核 |
| 粒子的电荷数 | 一个单位正电荷 | 一个单位负电荷 | 0 |


查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com