
| 粒子代码 | X | Y | Z |
| 原子核数 | 单核 | 两核 | 四核 |
| 粒子的电荷数 | 一个单位正电荷 | 一个单位负电荷 | 0 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.X2YZ4 | B.X2YZ3 | C.X3YZ4 | D.XY2Z3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.同主族元素从上到下,元素原子得电子能力逐渐减弱,氢化物的稳定性逐渐增强 |
| B.除稀有气体元素外,第三周期元素的原子半径不一定比第二周期元素的原子半径大 |
| C.化学反应的过程中一定伴随着热量的变化 |
| D.在主族元素中,最外层电子数少的元素原子一定比最外层电子数多的元素原子失电子能力强高 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
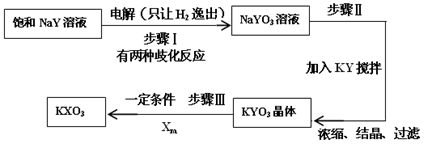
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.由14N2和15N2组成的物质是混合物 |
| B.在常温常压下,11.2L氧气所含的原子数目为NA |
| C.第三周期的元素从左往右非金属性逐渐增强 |
| D.电解MgCl2饱和溶液,可制得金属镁 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 离子化合物 | AB | CD | EF |
| 离子电荷数 | 1 | 1 | 2 |
| 键长(10-10m) | 2.31 | 3. 18 | 2.10 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.131I、132I、134Cs、137Cs是四种不同的核素 | B.食用碘盐不能防辐射 |
| C.碘片的主要成分是I2 | D.核能仍然是重要能源之一 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 物一定是离子化合物⑦所有的原子晶体都不导电
物一定是离子化合物⑦所有的原子晶体都不导电| A.①② | B.①⑥ | C.③④⑤ | D.⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com