
对常温下0.1 mol/L的醋酸溶液,以下说法正确的是
| A.由水电离出来的的c(H+)=1.0×10-13 mol/L |
| B.c(CH3COOH)>c(H+)>c(CH3COO-)>c(OH-) |
| C.与同浓度的盐酸分别加水稀释10倍后:pH(醋酸)>pH(盐酸) |
| D.与等浓度等体积NaOH溶液反应后的溶液中:c(CH3COOH)+c(CH3COO-)="0.1" mol/L |
BC
解析试题分析: A.由于醋酸是弱酸,部分电离,所以0.1 mol/L的醋酸溶液,酸电离产生的H+的浓度小于0.1mol/L,根据水的离子积常数可知,由水电离出来的的c(H+)小于1.0×10-13 mol/L,错误;B.醋酸是弱酸,电离程度很小,所以c(CH3COOH)>c(CH3COO-);在溶液中溶液的H+由酸和水电离产生,全部大于部分,因此c(H+)>c(CH3COO-),由于溶液中存在酸的电离作用故c(H+)>c(OH-)。酸的电离程度远大于水的电离程度,所以c(CH3COO-)>c(OH-)。故在整个溶液中离子浓度关系是c(CH3COOH)>c(H+)>c(CH3COO-)>c(OH-),正确;C.盐酸是强酸,尾气电离,而醋酸是弱酸,部分电离,当二者的物质的量浓度相等稀释相同倍数后,由于在醋酸中的酸电离产生的H+小,所以溶液的pH, pH(醋酸)>pH(盐酸),正确;D.根据物料守恒可知与等浓度等体积NaOH溶液反应后的溶液中:c(CH3COOH)+ c(CH3COO-)=c(Na+)="0.05" mol/L,错误。
考点:考查醋酸溶液的电离、离子浓度、溶液的pH的知识。


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案科目:高中化学 来源: 题型:计算题
在一密闭容器中发生反应: 2A(g)+B(g) E(g)
E(g)
(1)写出该反应的平衡常数表达式___________ ____,已知升高温度时,v(正)>v(逆),此时K值__ __(填“变大”“变小”或“不变”);该反应的△H_____0(填“>”、“=”、“<”);
(2)将1.0mol A和1.0mol B混合后装入2L容器中发生反应,E的物质的量的变化如图所示。
①3分钟内E的平均反应速率为________ _________;
②求此温度下该反应的平衡常数K= (结果保留小数后1位);
③请在图中画出5分钟内A的物质的量变化的曲线;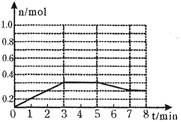
(3)已知在如图所示的变化中,平衡常数K保持不变,则在5~7min内引起E的物质的量变化的原因可能是____________(填编号)。
①降低了温度 ②升高了温度 ③使用了催化剂 ④增大了容器的体积 ⑤缩小了容器的体积 ⑥减少了A的物质的量。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气(标况),实验记录如下(累计值):
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
已知锌与稀硫酸反应为放热反应,某学生为了探究其反应过程中的速率变化,用排水集气法收集反应放出的氢气,实验记录如下:
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 30 | 120 | 280 | 350 | 370 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
(1)已知t ℃时AgCl的Ksp=2×10-10;(2)在t ℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )。
| A.在t ℃时,Ag2CrO4的Ksp为1×10-9 |
| B.在饱和Ag2CrO4溶液中加入K2CrO4可使溶液由Y点到X点 |
| C.在t℃时,以0.01 mol/L AgNO3溶液滴定20 mL0.01 mol/LKCl和0.01 mol/L的K2CrO4的混和溶液,Cl-先沉淀 |
| D.在t ℃时,AgCl的溶解度大于Ag2CrO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知某溶液中存OHˉ、H+、NH4+和C1ˉ四种离子,其浓度大小有如下关系:( )
①c(C1ˉ)>c(NH4+)>c(H+)>c(OH-)
②c(C1ˉ)>c(H+)>c(NH4+)>c(OH-)
③c(C1ˉ)=c(NH4+)且c(OHˉ)=c(H+)
④c(OHˉ)>c(H+)>c(C1ˉ)>c(NH4+)
⑤c(H+)>c(OH-)>c(C1-)>c(NH4+)
其中可能的是
| A.①④ | B.③⑤ | C.①②③ | D.④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
用相同浓度的标准盐酸滴定相同体积、相同pH的 、NaOH和NH3·H2O三种碱溶液,当恰好中和时,滴定消耗盐酸的体积依序为V1、V2、V3,则V1、V2、V3三者的大小关系正确的是
、NaOH和NH3·H2O三种碱溶液,当恰好中和时,滴定消耗盐酸的体积依序为V1、V2、V3,则V1、V2、V3三者的大小关系正确的是
| A.V3>V2>V1 | B.V3=V2=V1 | C.V1=V2>V3 | D.V3>V2=V1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列溶液中微粒浓度关系一定正确的是( )
| A.常温下,氨水与氯化铵的pH=7的混合溶液中:c(Cl-)>c(NH4+) |
| B.常温下,pH=2的一元酸和pH=12的一元强碱等体积混合: c(OH-)=c(H+) |
| C.0.1 mol·L—1的硫酸铵溶液中:c(NH4+)>c(SO42-)>c(H+) |
| D.0.1 mol·L—1的硫化钠溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com