
近几年,大气污染越来越严重,雾霾天气对人们的生活、出行、身体健康产生许多不利的影响。汽车尾气是主要的大气污染源。降低汽车尾气危害的方法之一是在排气管上安装催化转化器,发生的反应为:

则 ,△H=__________kJ
,△H=__________kJ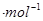 (用含a、b、c、d的式子表示)。
(用含a、b、c、d的式子表示)。
(2)某温度下,向容积为1L的容器中充人3 mol NO和1 mol CO, NO的转化率随时间的变化如下图所示。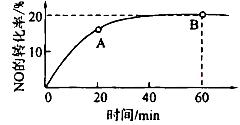
回答下列问题:
①该温度下,化学平衡常数K=___________,平衡时CO的转化率为__________。
②A点的逆反应速率逆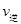 (CO)___________B点的逆反应速率
(CO)___________B点的逆反应速率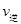 (NO)(填“>”、“<”或“=”)。
(NO)(填“>”、“<”或“=”)。
③下列图像正确且能表明在时间T1时刻反应一定处于平衡状态的是__________。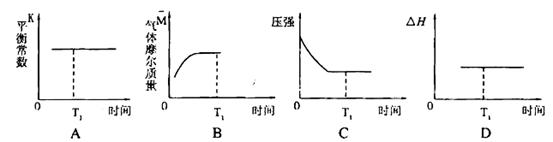
如果该反应达平衡后,降低温度,平衡常数增大,则△H___________0(填“>”、“< ”或“=”)
④达平衡后,将容器的容积扩大一倍,下列说法正确的是
| A.平衡向正反应方向移动 | B.CO的体积分数增大 |
| C.平衡常数减小 | D.一氧化碳的浓度增大 |
(1)△H=(2a+2b-2c-d0kJ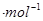 。(2)(2)①K=c2(CO2 )c(N2 )/c2(CO)c2(NO)=15/128,平衡时CO的转化率为0.6/1=60%。②小于。③BC④B
。(2)(2)①K=c2(CO2 )c(N2 )/c2(CO)c2(NO)=15/128,平衡时CO的转化率为0.6/1=60%。②小于。③BC④B
解析试题分析:(1) 反应热等于反应物的键能之和减去生成物的键能之和,故△H=(2a+2b-2c-d0kJ
反应热等于反应物的键能之和减去生成物的键能之和,故△H=(2a+2b-2c-d0kJ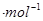 。(2)①该温度下,由图像可知NO转化了0.6mol,CO转化了0.6mol,生成氮气,二氧化碳分别为0.3mol,0.6mol,平衡时各物质浓度分别为:2.4,0.4,0.3,0.6mol/L,代入化学平衡常数K=c2(CO2 )c(N2 )/c2(CO)c2(NO)=15/128,平衡时CO的转化率为0.6/1=60%。②由于随着反应时行反应物浓度减小,速率减小,故A点的逆反应速率逆
。(2)①该温度下,由图像可知NO转化了0.6mol,CO转化了0.6mol,生成氮气,二氧化碳分别为0.3mol,0.6mol,平衡时各物质浓度分别为:2.4,0.4,0.3,0.6mol/L,代入化学平衡常数K=c2(CO2 )c(N2 )/c2(CO)c2(NO)=15/128,平衡时CO的转化率为0.6/1=60%。②由于随着反应时行反应物浓度减小,速率减小,故A点的逆反应速率逆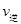 (CO)小于B点的逆反应速率
(CO)小于B点的逆反应速率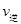 (NO)。③A中平衡常数只与外界温度有关,无论是平衡还是没有平衡只要温度不变,就是定值,错误;B图气体摩尔质量始终在变化,可以证明。C中没有平衡时压强将在变小,平衡时压强不变化,正确。D中反应热只与反应物和生成物的状态和量有关,无法证明其是否平衡。如果该反应达平衡后,降低温度,平衡常数增大,说明平衡正向移动,那正反应就是放热反应,则△H<0。④达平衡后,将容器的容积扩大一倍,相当于减小了压强,平衡向体积增大方向移动,即向逆方向移动, A错误; B.CO的体积分数增大,正确;C.平衡常数只与温度有关,错误。 D.由于体积的增大比一氧化碳的物质的量增大还要大,浓度再减小,错误。
(NO)。③A中平衡常数只与外界温度有关,无论是平衡还是没有平衡只要温度不变,就是定值,错误;B图气体摩尔质量始终在变化,可以证明。C中没有平衡时压强将在变小,平衡时压强不变化,正确。D中反应热只与反应物和生成物的状态和量有关,无法证明其是否平衡。如果该反应达平衡后,降低温度,平衡常数增大,说明平衡正向移动,那正反应就是放热反应,则△H<0。④达平衡后,将容器的容积扩大一倍,相当于减小了压强,平衡向体积增大方向移动,即向逆方向移动, A错误; B.CO的体积分数增大,正确;C.平衡常数只与温度有关,错误。 D.由于体积的增大比一氧化碳的物质的量增大还要大,浓度再减小,错误。
考点:本题考查反应热的计算,化学平衡常数及化学反应转化率的计算,化学平衡状态的判断,化学平衡移动。


 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:填空题
研究SO2、CO等大气污染物的处理与利用具有重大意义。
Ⅰ.利用钠碱循环法可脱除烟气中SO2,该法用Na2SO3溶液作为吸收剂,吸收过程pH随n(SO)?n(HSO3-)变化关系如下表:
| n(SO32-)?n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
 CH3OH(g)。
CH3OH(g)。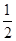 O2(g)=H2O(g) ΔH=-241.8 kJ/mol。
O2(g)=H2O(g) ΔH=-241.8 kJ/mol。| 化学键 | H—H | H—O | C—H | C—O | C=O |
| 键能 | 435 | 463 | 413 | 356 | 745 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
甲醇燃料分为甲醇汽油和甲醇柴油。工业上合成甲醇的方法很多。
(1)一定条件下发生反应:
①CO2(g) +3H2(g) =CH3OH(g)+H2O(g) △H1
②2CO(g) +O2(g) =2CO2(g) △H2
③2H2(g)+O2(g) =2H2O(g) △H3
则CO(g) + 2H2(g)  CH3OH(g) 的△H= 。
CH3OH(g) 的△H= 。
(2)在容积为2L的密闭容器中进行反应: CO(g)+2H2(g) CH3OH(g) ,其他条件不变,在300℃和500℃时,物质的量n(CH3OH) 与反应时间t的变化曲线如图所示。该反应的△H 0 (填>、<或=)。
CH3OH(g) ,其他条件不变,在300℃和500℃时,物质的量n(CH3OH) 与反应时间t的变化曲线如图所示。该反应的△H 0 (填>、<或=)。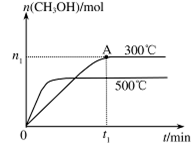
(3)若要提高甲醇的产率,可采取的措施有____________(填字母)。
| A.缩小容器体积 |
| B.降低温度 |
| C.升高温度 |
| D.使用合适的催化剂 |
 CO+3H2,T℃时,向1 L密闭容器中投入1 mol CH4和1 mol H2O(g),5小时后测得反应体系达到平衡状态,此时CH4的转化率为50% ,计算该温度下的平衡常数 (结果保留小数点后两位数字)。
CO+3H2,T℃时,向1 L密闭容器中投入1 mol CH4和1 mol H2O(g),5小时后测得反应体系达到平衡状态,此时CH4的转化率为50% ,计算该温度下的平衡常数 (结果保留小数点后两位数字)。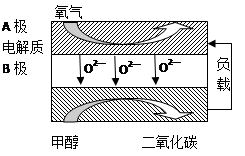
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
高炉炼铁是冶炼铁的主要方法,发生的主要反应为:Fe2O3(s)+3CO(g)??2Fe(s)+3CO2(g)
ΔH=a kJ·mol-1。
(1)已知:①Fe2O3(s)+3C(s,石墨)=2Fe(s)+3CO(g)
ΔH1=+489.0 kJ·mol-1;
②C(s,石墨)+CO2(g)=2CO(g) ΔH2=+172.5 kJ·mol-1。则a=________。
(2)冶炼铁反应的平衡常数表达式K=________,温度升高后,K值________(填“增大”、“不变”或“减小”)。
(3)在T ℃时,该反应的平衡常数K=64,在2 L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
| | Fe2O3 | CO | Fe | CO2 |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
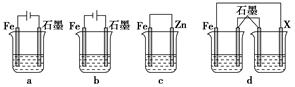
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
北京时间2013年12月2日凌晨1时30分,我国的“嫦娥三号”月球探测器在西昌卫星发射中心发射升空,发射“嫦娥三号”月球探测器的火箭推进器中装有还原剂肼(N2H4)和氧化剂N2O4,当它们混合时,即产生大量的氮气和水蒸气,并放出大量的热。已知0.4 mol气态肼和足量N2O4气体反应生成氮气和水蒸气时放出219.3 kJ的热量。
(1)写出肼和N2O4反应的热化学方程式: ;
(2)已知H2O(l)=H2O(g) ΔH=+44 kJ·mol-1,则16 g气态肼与足量N2O4气体反应生成氮气和液态水时,放出的热量是 ;
(3)肼除应用于火箭燃料外,还可作为燃料电池的燃料,由肼和空气构成的碱性燃料电池的负极反应式为: ,正极反应式为: ;
(4)向次氯酸钠溶液中通入一定物质的量的氨气可生成肼,写出反应的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
为了提高资源利用率,减少环境污染,化工集团将钛厂、氯碱厂和甲醇厂组成产业链,如图所示。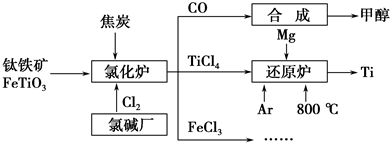
请填写下列空白:
(1)钛铁矿进入氯化炉前通常采取洗涤、粉碎、烘干、预热等物理方法处理,请从原理上解释粉碎的作用:_______________________________________;
已知氯化炉中反应氯气和焦炭的理论用料物质的量比为7∶6,则氯化炉中的还原剂化学式是_________________________________________________。
(2)已知:①Mg(s)+Cl2(g)=MgCl2(s) ΔH=-641 kJ·mol-1
②2Mg(s)+TiCl4(s)=2MgCl2(s)+Ti(s) ΔH=-512 kJ·mol-1
则Ti(s)+2Cl2(g)=TiCl4(s) ΔH=________。
(3)Ar气通入还原炉中并不参与反应,通入Ar气的作用是_________________________________________________________________。
(4)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。已知该燃料电池的总反应式为2CH3OH+3O2+4OH-===2CO32—+6H2O,该电池中正极上的电极反应式为____________________________________________。
工作一段时间后,测得溶液的pH________(填“减小”、“增大”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
将煤转化为水煤气的主要化学反应为C(s)+H2O(g)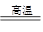 CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ·mol-1
H2(g)+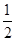 O2(g)=H2O(g) ΔH=-242.0 kJ·mol-1
O2(g)=H2O(g) ΔH=-242.0 kJ·mol-1
CO(g)+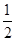 O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
请回答:
(1)根据以上数据,写出C(s)与水蒸气反应的热化学反应方程式:_______________________________。
(2)比较反应热数据可知,1 mol CO(g)和1 mol H2(g)完全燃烧放出的热量之和比1 mol C(s)完全燃烧放出的热量多。甲同学据此认为“煤转化为水煤气可以使煤燃烧放出更多的热量”;乙同学根据盖斯定律做出如图循环图
并据此认为“煤转化为水煤气再燃烧放出的热量与煤直接燃烧放出的热量相等”。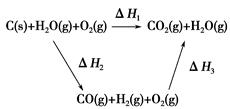
请分析:甲、乙两同学观点正确的是________(填“甲”或“乙”);判断的理由是________________________________________________________。
(3)将煤转化为水煤气作为燃料和煤直接燃烧相比有很多优点,请列举其中的两个优点___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。化工行业的发展必须符合国家节能减排的总体要求,依靠理论知识做基础。试运用所学知识,解决下列问题:
(1)已知某反应的平衡表达式为: 它所对应的化学反应为:_____________________________
它所对应的化学反应为:_____________________________
(2)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g) CH3OH(g);ΔH=-90.8 kJ/mol
CH3OH(g);ΔH=-90.8 kJ/mol
②2CH3OH(g) CH3OCH3(g)+H2O(g);ΔH=-23.5 kJ/mol
CH3OCH3(g)+H2O(g);ΔH=-23.5 kJ/mol
③CO(g)+ H2O(g) CO2(g)+H2(g);ΔH=-41.3 kJ/mol
CO2(g)+H2(g);ΔH=-41.3 kJ/mol
总反应:3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)的ΔH="__________" ,
CH3OCH3(g)+CO2(g)的ΔH="__________" ,
二甲醚(CH3OCH3)直接作燃料电池具有启动快,效率高等优点,若电解质为酸性,该电池的负极反应为_____________________________。
(3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g) H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
 2NO2(g) △H>0,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是___________。
2NO2(g) △H>0,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是___________。

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氨是最重要的化工产品之一。
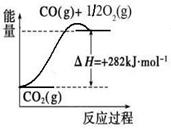
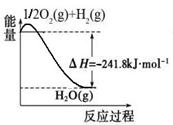
(1)合成氨用的氢气可以甲烷为原料制得:CH4(g)+H2O(g) CO(g)+3H2(g)。有关化学反应的能量变化如下图所示。CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为 。
CO(g)+3H2(g)。有关化学反应的能量变化如下图所示。CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为 。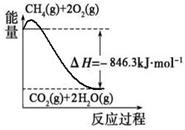
(2)CO对合成氨的催化剂有毒害作用,常用乙酸二氨合铜(Ⅰ)溶液来吸收原料气中CO,其反应原理为:[Cu(NH3)2CH3COO](l)+CO(g)+NH3(g) [Cu(NH3)3]CH3COO·CO(l) △H<0。吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,再生的适宜条件是 __________(填写选项编号)。
[Cu(NH3)3]CH3COO·CO(l) △H<0。吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,再生的适宜条件是 __________(填写选项编号)。
A.高温、高压 B.高温、低压 C.低温、低压 D.低温、高压
(3)用氨气制取尿素[CO(NH2)2]的反应为:2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g) △H<0。某温度下,向容积为100L的密闭容器中通入4mol NH3和2molCO2,该反应进行到40 s时达到平衡,此时CO2的转化率为50%。该温度下此反应平衡常数K的值为________。下图中的曲线表示该反应在前25 s内的反应进程中的NH3浓度变化。若反应延续至70s,保持其它条件不变情况下,请在图中用实线画出使用催化剂时该反应的进程曲线。
CO(NH2)2(l)+H2O(g) △H<0。某温度下,向容积为100L的密闭容器中通入4mol NH3和2molCO2,该反应进行到40 s时达到平衡,此时CO2的转化率为50%。该温度下此反应平衡常数K的值为________。下图中的曲线表示该反应在前25 s内的反应进程中的NH3浓度变化。若反应延续至70s,保持其它条件不变情况下,请在图中用实线画出使用催化剂时该反应的进程曲线。
(4)将尿素施入土壤后,大部分是通过转化为碳酸铵或碳酸氢铵后才被作物所利用,尿素分子在微生物分泌的脲酶作用下,转化为碳酸铵。已知弱电解质在水中的电离平衡常数(25℃)如下表:
| 弱电解质 | H2CO3 | NH3·H2O |
| 电离平衡常数 | Ka1=4.30×10-7 Ka2=5.61×10-11 | 1.77×10-5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com