
�״�ȼ�Ϸ�Ϊ�״����ͺͼ״����͡���ҵ�Ϻϳɼ״��ķ����ܶࡣ
��1��һ�������·�����Ӧ��
��CO2��g�� +3H2��g�� ��CH3OH��g��+H2O��g�� ��H1
��2CO��g�� +O2��g�� ��2CO2��g�� ��H2
��2H2��g��+O2��g�� ��2H2O��g�� ��H3
��CO��g�� + 2H2��g��  CH3OH��g�����ġ�H�� ��
CH3OH��g�����ġ�H�� ��
��2�����ݻ�Ϊ2L���ܱ������н��з�Ӧ�� CO��g��+2H2��g�� CH3OH��g�� �������������䣬��300���500��ʱ�����ʵ���n��CH3OH�� �뷴Ӧʱ��t�ı仯������ͼ��ʾ���÷�Ӧ�ġ�H 0 ����>��<��=����
CH3OH��g�� �������������䣬��300���500��ʱ�����ʵ���n��CH3OH�� �뷴Ӧʱ��t�ı仯������ͼ��ʾ���÷�Ӧ�ġ�H 0 ����>��<��=����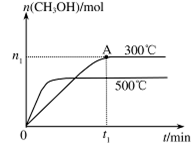
��3����Ҫ��״��IJ��ʣ��ɲ�ȡ�Ĵ�ʩ��____________������ĸ����
| A����������� |
| B�������¶� |
| C�������¶� |
| D��ʹ�ú��ʵĴ��� |
 CO+3H2��T��ʱ����1 L�ܱ�������Ͷ��1 mol CH4��1 mol H2O��g����5Сʱ���÷�Ӧ��ϵ�ﵽƽ��״̬����ʱCH4��ת����Ϊ50% ��������¶��µ�ƽ�ⳣ�� ���������С�������λ���֣���
CO+3H2��T��ʱ����1 L�ܱ�������Ͷ��1 mol CH4��1 mol H2O��g����5Сʱ���÷�Ӧ��ϵ�ﵽƽ��״̬����ʱCH4��ת����Ϊ50% ��������¶��µ�ƽ�ⳣ�� ���������С�������λ���֣���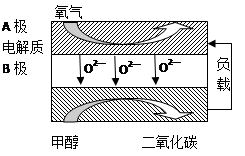
 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
̼��̼�Ļ�����㷺�Ĵ��������ǵ������С�
��1���������з�Ӧ�������仯ʾ��ͼ��2C(s) +O2(g) =2CO(g) ��H= ��
��2�������Ϊ2L���ܱ������У�����1 mol CO2��3mol H��һ�������·�����Ӧ�� CO2(g)+3H2(g) CH3OH(g)+H2O(g) ��H<O���CO2(g)��CH3OH(g)�����ʵ�����ʱ��仯��������ͼ��ʾ��
CH3OH(g)+H2O(g) ��H<O���CO2(g)��CH3OH(g)�����ʵ�����ʱ��仯��������ͼ��ʾ��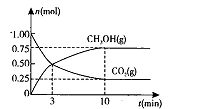
�ٴӷ�Ӧ��ʼ��ƽ�⣬H2O��ƽ����Ӧ����v(H2O)= ��
�����д�ʩ����ʹ��ѧƽ��������Ӧ�����ƶ����� �����ţ���
A�������¶� B����CH3OH��g����ʱҺ���Ƴ�
C��ѡ���Ч���� D���ٳ���l mol CO2��4 mol H2
��3��CO2����ˮ����̼�ᡣ��֪�������ݣ�
| ������� | H2CO3 | NH3��H2O |
| ����ƽ�ⳣ���� 25�棩 | Ka1 = 4��30 �� 10һ7 Ka2= 5��61�� 10һ11 | Kb = 1��77�� 10һ5 |
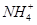 ˮ���ƽ�ⳣ��Kh=Kw/Kb��
ˮ���ƽ�ⳣ��Kh=Kw/Kb��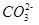
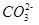 ������һ��ˮ������ӷ���ʽ ��
������һ��ˮ������ӷ���ʽ ��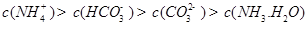

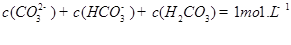
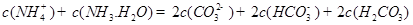
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�����������������йط�Ӧ���ʱ䣺
��1����֪��Ti(s)��2Cl2(g)=TiCl4(l)��H����804��2 kJ��mol��1
2Na(s)��Cl2(g)=2NaCl(s)����H����882��0 kJ��mol��1
Na(s)=Na(l)����H����2��6 kJ��mol��1
��ӦTiCl4(l)��4Na(l)=Ti(s)��4NaCl(s)�Ħ�H��________ kJ��mol��1��
��2����֪���з�Ӧ��ֵ��
| ��Ӧ��� | ��ѧ��Ӧ | ��Ӧ�� |
| �� | Fe2O3(s)��3CO(g)= 2Fe(s)��3CO2(g) | ��H1����26��7 kJ��mol��1 |
| �� | 3Fe2O3(s)��CO(g)=2Fe3O4(s)��CO2(g) | ��H2����50��8 kJ��mol�� |
| �� | Fe3O4(s)��CO(g)=3FeO(s)��CO2(g) | ��H3����36��5 kJ��mol��1 |
| �� | FeO(s)��CO(g)=Fe(s)��CO2(g) | ��H4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
���ڵؿ�����Ҫ����������ε���ʽ���ڣ��䵥�ʺͻ������ڹ�ũҵ������������Ҫ��Ӧ�á�
��1����֪���ؾ�ʯ��BaSO4���������տɷ���һϵ�з�Ӧ�����в��ַ�Ӧ���£�
BaSO4(s)+4C(s)=BaS(s)+4CO(g) ��H=" +" 571.2 kJ?mol��1
BaS(s)= Ba(s)+S(s) ��H=" +460" kJ?mol��1
��֪��2C(s)+O2(g)=2CO(g) ��H=" -221" kJ?mol��1
��Ba(s)+S(s)+2O2(g)=BaSO4(s) ��H= ��
��2���ۻ�(As4S4)�ʹƻ�(As2S3)����ȡ�����Ҫ����ԭ�ϡ���֪As2S3��HNO3�����·�Ӧ��
As2S3+10H++ 10NO3-=2H3AsO4+3S+10NO2��+ 2H2O
����Ӧ��ת�Ƶ��ӵ���ĿΪ2molʱ������H3AsO4�����ʵ���Ϊ ��
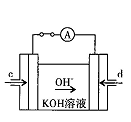
��3��������ʵ���Ũ��Na2S��NaOH�����Һ�еμ�ϡ������������������Ҫ��������֣�H2S��HS����S2�����ķֲ�������ƽ��ʱij���ֵ�Ũ��ռ������Ũ��֮�͵ķ�������μ���������Ĺ�ϵ����ͼ��ʾ�����Եμӹ���H2S������ݳ�����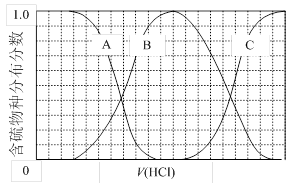
�ٺ�������B��ʾ ���ڵμ���������У���Һ��c(Na+)�뺬�������Ũ�ȵĴ�С��ϵΪ (����ĸ)��
a��c(Na+)= c(H2S)+c(HS��)+2c(S2��)
b��2c(Na+)=c(H2S)+c(HS��)+c(S2��)
c��c(Na+)=3[c(H2S)+c(HS��)+c(S2��)]
��NaHS��Һ�ʼ��ԣ�������Һ�м���CuSO4��Һ��ǡ����ȫ��Ӧ��������Һ��ǿ���ԣ���ԭ���� �������ӷ���ʽ��ʾ����
��4������л��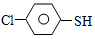 �����ȩ���Ȼ��������ʵ���֮��1:1:1��Ӧ���ɻ��һ��ɱ����м���X��H2O��
�����ȩ���Ȼ��������ʵ���֮��1:1:1��Ӧ���ɻ��һ��ɱ����м���X��H2O�� ��X�ĺ˴Ź�����������ͼ������ �����Ϊ
��X�ĺ˴Ź�����������ͼ������ �����Ϊ �ĺ˴Ź�������ͼ��д��X�Ľṹ��ʽ�� ��
�ĺ˴Ź�������ͼ��д��X�Ľṹ��ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
һ�������£������Ϊ3 L���ܱ������з�Ӧ��CO��g��+ 2H2��g�� CH3OH��g���ﵽ��ѧƽ��״̬��
CH3OH��g���ﵽ��ѧƽ��״̬��
��1���÷�Ӧ��ƽ�ⳣ������ʽK= ��������ͼ�������¶ȣ�Kֵ�� �����������С�����䡱����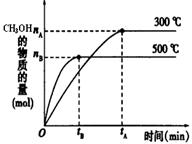
��2��500��ʱ���ӷ�Ӧ��ʼ���ﵽ��ѧƽ�⣬��H2��Ũ�ȱ仯��ʾ�Ļ�ѧ��Ӧ������ ����nB��tB��ʾ����
��3���жϸÿ��淴Ӧ�ﵽ��ѧƽ��״̬�ı�־�� ������ĸ����
a��CO��H2��CH3OH��Ũ�Ⱦ����ٱ仯
b�����������ܶȲ��ٸı�
c����������ƽ����Է����������ٸı�
d��v������CH3OH��= v������CO��
��4��300��ʱ�����������ݻ�ѹ����ԭ����1/2���������������������£���ƽ����ϵ������Ӱ���� ������ĸ����
a��c��H2������
b������Ӧ���ʼӿ죬�淴Ӧ���ʼ���
c��CH3OH �����ʵ�������
d������ƽ��ʱc��H2��/ c��CH3OH����С
��5��������Ŀ�й���Ϣ��������������ͼ�б�ʾ���û�ѧ��Ӧ���̵������仯��������Ϣ����
��6���Լ״�������������������ҺΪԭ�ϣ�ʯīΪ�缫�ɹ���ȼ�ϵ�ء���֪��ȼ�ϵ�ص��ܷ�ӦʽΪ��2CH3OH +3O2+4OH- = 2CO32- + 6H2O���õ���и����ϵĵ缫��Ӧʽ�ǣ�2CH3OH�C12e��+16OH���� 2CO32��+ 12H2O ���������Ϸ����ĵ缫��ӦΪ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
���ǵ�ѭ�������е���Ҫ����,���ĺϳ���Ŀǰ�ձ�ʹ�õ��˹��̵�������
(1)����ͼ1�ṩ����Ϣ,д���÷�Ӧ���Ȼ�ѧ����ʽ:��������������������������������������������,��ͼ1��������������������(�a����b��)��ʾ��������ý�������仯���ߡ� 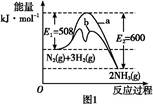
(2)�ں���������,������������˵��������Ӧ�Ѵ�ƽ���������������
A.3v(H2)��=2v(NH3)��
B.��λʱ��������n mol N2��ͬʱ����2n mol NH3
C.���������ܶȲ��ٸı�
D.������ѹǿ����ʱ��ı仯���仯
(3)һ���¶���,��2 L�ܱ������г���1 mol N2��3 mol H2,�����������,0.5 min��ﵽƽ��,�����������0.4 mol NH3,��ƽ����Ӧ����v(N2)=������������,���¶��µ�ƽ�ⳣ��K=�����������������������¶�,Kֵ�仯��������(���������С�����䡱)��
(4)Ϊ��Ѱ�Һϳ�NH3���¶Ⱥ�ѹǿ����������,ijͬѧ���������ʵ��,����ʵ�������Ѿ���������ʵ����Ʊ��С�
| ʵ���� | T(��) | n(N2)/n(H2) | p(MPa) |
| �� | 450 | 1/3 | 1 |
| �� | �� | �� | 10 |
| �� | 480 | �� | 10 |
 2NH3(g)���ص�,�ڸ���������ͼ2��,��������1 MPa��10 MPa������H2��ת�������¶ȱ仯����������ʾ��ͼ,�������������ߵ�ѹǿ��
2NH3(g)���ص�,�ڸ���������ͼ2��,��������1 MPa��10 MPa������H2��ת�������¶ȱ仯����������ʾ��ͼ,�������������ߵ�ѹǿ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��ԴΣ���ǵ�ǰȫ�����⣬��Դ������Ӧ����ԴΣ������Ҫ�ٴ롣
(1)����������������Դ����Դ����������________(�����)��
a��������չũ���������������Ľո�ת��Ϊ����Ч����Դ
b����������ú��ʯ�ͺ���Ȼ������������������������Դ����
c������̫���ܡ�ˮ�ܡ����ܡ������ܵ�����Դ������ʹ��ú��ʯ�͵Ȼ�ʯȼ��
d��������Դ���ģ�������Դ���ظ�ʹ�á���Դ��ѭ������
(2)���ʯ��ʯī��Ϊ̼��ͬ�������壬����ȼ����������ʱ����һ����̼�����ȼ�����ɶ�����̼����Ӧ�зų���������ͼ��ʾ��
����ͨ��״���£����ʯ��ʯī��________(����ʯ����ʯī��)���ȶ���ʯī��ȼ����Ϊ________��
��12 gʯī��һ����������ȼ�գ���������36 g���ù��̷ų�������________��
(3)��֪��N2��O2�����л�ѧ���ļ��ֱܷ���946 kJ��mol��1��497 kJ��mol��1��
N2(g)��O2(g)=2NO(g)����H��180.0 kJ��mol��1��
NO�����л�ѧ���ļ���Ϊ________kJ��mol��1��
(4)�ۺ������й���Ϣ����д��CO��NO��Ӧ���Ȼ�ѧ����ʽ_________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�����꣬������ȾԽ��Խ���أ��������������ǵ�������С����彡�������������Ӱ�졣����β������Ҫ�Ĵ�����ȾԴ����������β��Σ���ķ���֮һ�����������ϰ�װ��ת�����������ķ�ӦΪ��

�� ,��H=__________kJ
,��H=__________kJ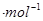 ���ú�a��b��c��d��ʽ�ӱ�ʾ����
���ú�a��b��c��d��ʽ�ӱ�ʾ����
��2��ij�¶��£����ݻ�Ϊ1L�������г���3 mol NO��1 mol CO, NO��ת������ʱ��ı仯����ͼ��ʾ��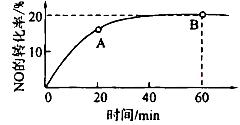
�ش��������⣺
�ٸ��¶��£���ѧƽ�ⳣ��K=___________��ƽ��ʱCO��ת����Ϊ__________��
��A����淴Ӧ������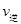 (CO)___________B����淴Ӧ����
(CO)___________B����淴Ӧ����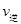 (NO)���>������<����=������
(NO)���>������<����=������
������ͼ����ȷ���ܱ�����ʱ��T1ʱ�̷�Ӧһ������ƽ��״̬����__________��
����÷�Ӧ��ƽ������¶ȣ�ƽ�ⳣ���������H___________0���>������< ����=����
�ܴ�ƽ����������ݻ�����һ��������˵����ȷ����
| A��ƽ��������Ӧ�����ƶ� | B��CO������������� |
| C��ƽ�ⳣ����С | D��һ����̼��Ũ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
ͭ���ʼ��仯�����ڹ�ҵ�����Ϳ���������Ҫ���á�
��1����֪��2Cu2O(s) + O2(g) = 4CuO(s)��H����292kJ��mol��1
2C(s)+O2(g)=2CO(g) ��H����221kJ��mol��1
��д��������̿�ۻ�ԭCuO��s���Ʊ�Cu2O��s�����Ȼ�ѧ����ʽ�� ��
��2�������Ȼ�ͭ����(CuCl2��2H2O�����Ȼ���������)��ȡ������CuCl2��2H2O���Ƚ����Ƴ�ˮ��Һ������ͼ��������ᴿ: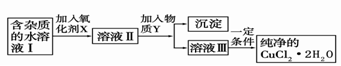
��֪Cu2+��Fe3+��Fe2+���������↑ʼ�����ͳ�����ȫʱ��pH���±�
| �������� | Fe3+ | Fe2+[��Դ:ѧ&��& | Cu2+ |
| �������↑ʼ����ʱ��pH | 1.9 | 7.0 | 4.7 |
| ����������ȫ����ʱ��pH | 3.2 | 9.0 | 6.7 |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com