
【题目】可逆反应A(g)+B![]() C(g)+D,达到平衡时,下列说法不正确的是
C(g)+D,达到平衡时,下列说法不正确的是
A. 若B是气体,增大A的浓度会使B转化率增大
B. 若增大A的浓度,平衡体系颜色加深,D不一定是有颜色的气体
C. 升高温度,C百分含量减少,说明正反应是放热反应
D. 增大压强,平衡不移动,说明B是气体
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.纺织品上的矿物油可以用烧碱溶液清洗
B.用钢瓶储存液氯或浓硫酸
C.在船身上装锌块是使用了外加电流的阴极保护法
D.葡萄糖溶液和淀粉溶液都可产生丁达尔效应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是合成抗心律失常药物决奈达隆的一种中间体,可通过以下方法合成:

(1))D中的含氧官能团名称为________________(写三种)。
(2)F→G的反应类型为____________。
(3)写出同时满足下列条件的C的一种同分异构体的结构简式:_______________________。
①能发生银镜反应
②能发生水解反应,其水解产物之一能与FeCl3溶液发生显色反应
③分子中只有4种不同化学环境的氢。
(4)E经还原得到F,E的分子式为C14H17O3N,写出E的结构简式:________________________。
(5)已知:
①苯胺(![]() )易被氧化。
)易被氧化。
②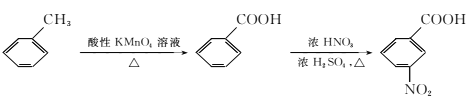
请以甲苯和(CH3CO)2O为原料制备 ,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。 ______________________
,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。 ______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(CH3)2C(C2H5)CH(CH3)2的名称是
A.3,3,4-三甲基戊烷B.2,3-二甲基-3-乙基丁烷
C.2,3,3-三甲基戊烷D.2,3-二甲基-2-乙基丁烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应A2(g)+2B2(g)![]() 2AB2(g)△H <0,下列说法正确的( )
2AB2(g)△H <0,下列说法正确的( )
A. 升高温度有利于反应速率增加,从而缩短达到平衡的时间
B. 升高温度,正向反应速率增加,逆向反应速率减小
C. 达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动
D. 达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应速率的说法正确的是
A. 用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率
B. 汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率减慢
C. SO2的催化氧化是一个放热的反应,所以升高温度,反应速率减慢
D. 100mL2mol/L的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100℃时,将0.1mol N2O4置于1L密闭的烧瓶中,烧瓶内的气体逐渐变为红棕色:N2O4(g)![]() 2NO2 (g),下列结论不能说明上述反应在该条件下已经达到平衡状态的是
2NO2 (g),下列结论不能说明上述反应在该条件下已经达到平衡状态的是
①N2O4的消耗速率与NO2的生成速率之比为1:2
②NO2生成速率与NO2消耗速率相等
③烧瓶内气体的压强不再变化
④烧瓶内气体的质量不再变化
⑤NO2的物质的量浓度不再改变
⑥烧瓶内气体的颜色不再加深
⑦烧瓶内气体的平均相对分子质量不再变化
⑧烧瓶内气体的密度不再变化
A. ②③⑥⑦ B. ①④⑧ C. 只有①④ D. ①④ ⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,不能观察到明显变化的是
A. 金属钾投人水中 B. 镁条放人冷水中
C. KSCN溶液滴加到FeCl3溶液中 D. 氯水滴加到KI淀粉溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味,实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下:

实验步骤:
在A中加入4.4 g的异戊醇、6.0 g的乙酸、数滴浓硫酸和2~3片碎瓷片。开始缓慢加热A,回流50min。反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤;分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集140~143 ℃馏分,得乙酸异戊酯3.9 g。
回答下列问题:
(1)仪器B的名称是______。
(2)在洗涤操作中,第一次水洗的主要目的是____________,第二次水洗的主要目的是___________。
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后______(填标号)。
a.直接将乙酸异戊酯从分液漏斗的上口倒出
b.直接将乙酸异戊酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出
(4)本实验中加入过量乙酸的目的是________________。
(5)实验中加入少量无水MgSO4的目的是___________。
(6)在蒸馏操作中,仪器选择及安装都正确的是______(填标号)。

(7)本实验的产率是______(填标号)。
a.30℅ b.40℅ c.60℅ d.90℅
(8)在进行蒸馏操作时,若从130 ℃便开始收集馏分,会使实验的产率偏__(填“高”或“低”), 原因是_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com