
A、B是短周期VIIA族的两种元素,A的非金属性比B强。下列关于A、B的说法正确的是
A.A元素的单质可以把B元素的单质从NaB溶液中置换出来
B.NaA、NaB的晶体都是离子晶体,且NaA晶体的熔点比NaB高
C.HA的沸点比HB高,是因为1mol HA分子中H-A键断裂时吸附的能量比1mol
? HB分子中H-B键断裂时吸收的能量多
D.常温下, 溶液的pH均大于7
溶液的pH均大于7
B
【解析】
试题分析:A、A、B是短周期VIIA族的两种元素,A的非金属性比B强,则A为F元素,B为Cl元素,F2与NaCl溶液反应,实际反应为F2与H2O反应生成O2,错误;B、短周期VIIA族为活泼非金属,与Na元素结合的化合物为离子化合物,F?半径小于Cl?半径,则NaF的晶格能大于NaCl的晶格能,所以NaF晶体的熔点比NaCl高,正确;C、HF的沸点比HCl的沸点高,是因为HF分子间形成了氢键,作用力大于HCl分子间的范德华力,错误;D、因为NaCl为强酸强碱盐,所以常温下,NaCl溶液的pH等于7,错误。
考点:本题考查元素的推断、晶体的判断和性质、沸点的比较、溶液酸碱性的判断。


科目:高中化学 来源: 题型:
族 周期 |
I A | II A | III A | IV A | V A | VI A | VII A |
| 一 | |||||||
| 二 | a | b | d | e | |||
| 三 | f | g | h | j | |||
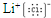
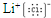
查看答案和解析>>
科目:高中化学 来源:09-10学年长阳一中高一下学期四月月考化学卷 题型:选择题
下列叙述正确的是 ( )
A.同周期元素的原子半径以VII A的为最大
B.同主族两种元素原子的核外电子数的差值可能为26
C.短周期中次外层电子数是最外层电子数2倍的原子一定是非金属元素
D.科学家在周期表中金属与非金属分界线处找到了优良的催化剂
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
族 周期 |
I A | II A | III A | IV A | V A | VI A | VII A |
| 一 | |||||||
| 二 | a | b | d | e | |||
| 三 | f | g | h | j | |||
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是 ( )
A.同周期元素的原子半径以VII A的为最大
B.同主族两种元素原子的核外电子数的差值可能为26
C.短周期中次外层电子数是最外层电子数2倍的原子一定是非金属元素
D.科学家在周期表中金属与非金属分界线处找到了优良的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是 ( )
A.同周期元素的原子半径以VII A的为最大
B.同主族两种元素原子的核外电子数的差值可能为26
C.短周期中次外层电子数是最外层电子数2倍的原子一定是非金属元素
D.科学家在周期表中金属与非金属分界线处找到了优良的催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com