
| A. | 淀粉、纤维素、蛋白质都是天然高分子化合物 | |
| B. | 用于奥运“祥云”火炬的丙烷是一种清洁燃料 | |
| C. | 纤维素、蔗糖、葡萄糖和脂肪在一定条件下都可发生水解反应 | |
| D. | 用大米酿的酒在一定条件下密封保存,时间越长越香醇 |
分析 A.根据高分子化合物的定义判断;
B.丙烷充分燃烧只生成二氧化碳和水;
C.葡萄糖为单糖,不能水解;
D.乙醇被氧化生成乙酸,可与乙酸反应生成乙酸乙酯.
解答 解:A.淀粉、纤维素、蛋白质相对分子质量较大,都为高聚物,为高分子化合物,故A正确;
B.丙烷充分燃烧只生成二氧化碳和水,为清洁燃料,故B正确;
C.葡萄糖为单糖,不能水解,故C错误;
D.乙醇被氧化生成乙酸,可与乙酸反应生成乙酸乙酯,则用大米酿的酒在一定条件下密封保存,时间越长越香醇,故D正确;故选C.
点评 本题考查有机物的结构和性质,为高频考点,侧重于学生的分析能力的考查,注意把握有机物的结构和官能团的性质,为解答该类题目的关键,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
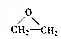 称为环氧乙烷,它在一定条件下,能与氢氧化物发生加成反应,氢原子加到氧原子上,其他部分加在碳原子上,下列对环氧乙烷的衍生物
称为环氧乙烷,它在一定条件下,能与氢氧化物发生加成反应,氢原子加到氧原子上,其他部分加在碳原子上,下列对环氧乙烷的衍生物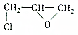 的叙述正确的是( )
的叙述正确的是( )| A. | 能与水反应生成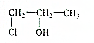 | |
| B. | 能碱性水解生成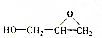 | |
| C. | 在一定条件下可以合成甘油 | |
| D. | 加入AgNO3溶液能生成难溶于硝酸的白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 温度/℃ | 500 | 525 | 550 | 575 | 600 |
| 平衡转化率/% | 93.5 | 90.5 | 85.6 | 80.0 | 73.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L己烷中含有分子的数目为0.5NA | |
| B. | 1mol/L CH3COOH溶液中含有CH3COOH分子的数目为NA | |
| C. | 78g 苯中含有碳碳双键的数目为3NA | |
| D. | 10g46%的乙醇水溶液中所含氢原子数目为1.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 萘(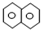 )是最简单的稠环芳香烃,萘与足量氢气充分加成的产物一氯代物有2种 )是最简单的稠环芳香烃,萘与足量氢气充分加成的产物一氯代物有2种 | |
| B. | 酚酞的结构如图所示,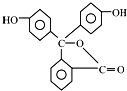 其结构中含有羟基(-OH),故酚酞属于醇 其结构中含有羟基(-OH),故酚酞属于醇 | |
| C. | 溴水能将甲苯、己烯、CCl4、乙醇四种溶液鉴别开来 | |
| D. | 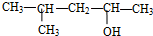 的名称为2-甲基-4-戊醇 的名称为2-甲基-4-戊醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 研究工业废弃物的处理和防治具有重要的意义.
研究工业废弃物的处理和防治具有重要的意义.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实 验 内 容 | 实 验 试 剂 | 实 验 现 象 |
| 探究氧化性 | 取适量碘化钾淀粉溶液于试管中,加入过氧化氢溶液 | 溶液变蓝色 |
| 探究不稳定性 | 取适量过氧化氢溶液于试管中,加热, 用带火星的木条检验 | 产生气泡,木条复燃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 红色 | B. | 紫色 | ||
| C. | 蓝色 | D. | 视溶液的酸碱性待定H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com