
【题目】根据图示回答问题:
(1)化学反应N2+3H2===2NH3的能量变化如图所示,该反应的热化学方程式是______(填字母)。
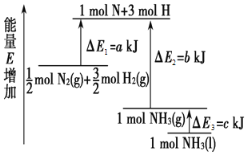
A.N2(g)+3H2(g)===2NH3(l)ΔH=2(a-b-c)kJ·mol-1
B. N2(g)+3H2(g)===2NH3(g)ΔH=2(b-a)kJ·mol-1
C.1/2N2(g)+3/2H2(g)===NH3(l)ΔH=(b+c-a) kJ·mol-1
D.1/2N2(g)+3/2H2(g)===NH3(g)ΔH=(a+b)kJ·mol-1
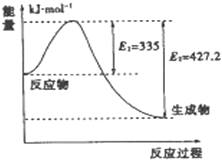
(2)如图是N2和H2反应生成2 mol NH3过程中能量变化的示意图,请计算每生成1 mol NH3放出的热量为__________________________。
(3)2SO2(g)+O2(g)===2SO3(g)反应过程的能量变化如图所示。
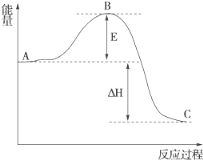
已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ·mol-1。
①图中A、C分别表示________、________,E的大小对该反应的反应热有无影响?___________________________________。
②图中ΔH=________kJ·mol-1。
【答案】A46.1 kJ反应物总能量生成物总能量无影响-198
【解析】
(1)由图可以看出,1/2molN2(g)+3/2molH2(g)的能量为akJ,1molNH3(g)的能量为bkJ,
所以1/2N2(g)+3/2H2(g)=NH3(g)ΔH=(a-b) kJ·mol-1;
而1mol的NH3(g)转化为1mol的NH3(l)放出的热量为ckJ,
所以有:1/2N2(g)+3/2H2(g)=NH3(l)ΔH=(a-b-c) kJ·mol-1,
即:N2(g)+3H2(g)=2NH3(l)ΔH=2(a-b-c)kJ·mol-1;.
综上所述,本题应选A;
(2)由题图可知生成2 mol NH3放出热量为427.2 kJ-335 kJ=92.2 kJ,则生成1 mol NH3放出热量为46.1 kJ;
(3)由图示可知,A表示反应物总能量,C表示生成物总能量,E值不影响A、C的能量值。故能量E的大小对该反应的反应热无影响。
②ΔH对应2 mol SO2(g)转化为2 mol SO3(g)的焓变,其值为2×(-99 kJ·mol-1)=-198 kJ·mol-1。


 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源: 题型:
【题目】某化学兴趣小组进行以下实验探究:


Ⅰ. 设计实验探究反应速率的测定和比较
实验步骤:
(1)取一套装置(装置如图所示),加入40 mL 1 mol·L-1的硫酸,测量收集10 mL H2所需的时间。
(2)取另一套装置,加入40 mL 4 mol·L-1的硫酸,测量收集10 mL H2所需的时间。
实验现象: 锌跟硫酸反应产生气泡,收集10 mL气体,(2)所用时间比(1)所用时间________(填“长”或“短”);
实验结论: 4 mol·L-1硫酸与锌反应比1 mol·L-1硫酸与锌反应速率______(填“大”或“小”)。
注意事项:① 锌粒的颗粒(即表面积)大小________________;
② 40 mL的硫酸要迅速加入;
③ 装置____________________,且计时要迅速准确;
④ 气体收集可以用排水量气装置代替。
实验讨论:除本实验测定反应速率的方法外,可行的方案还有(任写一种)
________________________________________________________________。
Ⅱ. 探究用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素,所用HNO3浓度为1.00 mol·L-1、2.00 mol·L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298 K、308 K。
请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
实验编号 | T(K) | 大理石规格 | HNO3浓度 (mol·L-1) | 实验目的 |
① | 298 | 粗颗粒 | 2.00 | (1)实验①和②探究HNO3浓度对该反应速率的影响 (2)实验①和_____探究温度对该反应速率的影响 (3)实验①和_____探究大理石规格(粗、细)对该反应速率的影响 |
② | _____ | ________ | _________ | |
③ | _____ | 粗颗粒 | _________ | |
④ | ______ | ______ | ________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图像分别表示有关反应的反应过程与能量变化的关系。


据此判断下列说法中正确的是( )
A. 石墨转变为金刚石是吸热反应 B. 白磷比红磷稳定
C. S(g)+O2(g)===SO2(g) ΔH1S(s)+O2(g)=SO2(g) ΔH2 则ΔH1>ΔH2 D. CO(g)+H2O(g)=CO2(g)+H2(g) ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔性碳棒)持续通入甲烷,在标准状况下,消耗甲烷体积VL。则下列说法正确的是( )

A.OH-由A端移向B端
B.0<V≤22.4L时,电池总反应的化学方程式为:CH4 + 2O2 + KOH = KHCO3 + 2H2O
C.22.4L<V≤44.8L时,负极电极反应为:CH4 - 8e- + 9CO32- + 3H2O = 10HCO3-
D.V=33.6L时,溶液中阴离子浓度大小关系为:c(CO32- )>c(HCO3- )>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列试剂的保存方法正确的是( )
A.浓硝酸保存在无色玻璃瓶中B.少量的白磷保存在冷水中
C.浓硫酸用橡胶塞细口瓶密闭保存D.烧碱溶液保存在玻璃塞试剂瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1 NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
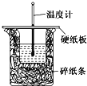
(1)从实验装置上看,图中尚缺少的一种玻璃用品是__________,烧杯间填满碎泡沫塑料的作用是________________________。
(2)大烧杯上如不盖硬纸板,则求得的中和热数值__(填“偏大”、“偏小”或“无影响”)。
(3)实验中若改用60 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1 NaOH溶液进行反应,与上述实验相比,所放出的热量______(填“相等”或“不相等”),所求中和热的数值______(填“相等”或“不相等”),理由是_______________________________。
(4)三次平行操作测得的数据中,起始时盐酸与烧碱溶液温度相同,而终止温度与起始温度之差(t2-t1)分别为2.3 ℃、2.4 ℃、2.9 ℃,则最终代入计算式的温度差的平均值为_____℃。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中。然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固。由此可见( )
A.NH4HCO3和盐酸的反应是放热反应
B.该反应中,热能转化为产物内部的能量
C.反应物的总能量高于生成物的总能量
D.反应的热化学方程式为:NH4HCO3+HCl=NH4Cl+CO2↑+H2O ΔH=+Q
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:

已知:
①2KOH + Cl2 = KCl + KClO + H2O(条件:温度较低)
②6KOH + 3Cl2 = 5KCl + KClO3 + 3H2O(条件:温度较高)
③2Fe(NO3)3 + 3KClO + 10KOH = 2K2FeO4 + 6KNO3 + 3KCl + 5H2O
回答下列问题:
(1)该生产工艺应在______________(填“温度较高”或“温度较低”)情况下进行,从绿色化学的角度考虑通入氯气速率应________(填“较快”或“较慢”);
(2)写出工业上制取Cl2的化学方程式_____________________________________;
(3)K2 FeO4可作为新型多功能水处理剂的原因是______________________;
(4)配制KOH溶液时,是在每100 mL水中溶解61.6 g KOH固体(该溶液的密度为1.47 g/mL),它的物质的量浓度为____________(保留整数);
(5)在“反应液I”中加KOH固体的目的是__________:
A.与“反应液I”中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供反应物
D.使副产物KClO3转化为 KClO
(6)从“反应液II”中分离出K2FeO4后,会有副产品_____________(写化学式)。
(7)该工艺每得到1.98 kg K2FeO4,理论上消耗Cl2的物质的量为___________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示物质结构的化学用语或模型图正确的是
A. H2O2的电子式:![]()
B. CO2的比例模型: ![]()
C. 丙烷分子的比例模型示意图:
D. 硅酸盐Ca2Mg3Si8O22(OH)2可用氧化物形式表示为:2CaO5MgO·8SiO2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com