
【题目】某化学兴趣小组进行以下实验探究:


Ⅰ. 设计实验探究反应速率的测定和比较
实验步骤:
(1)取一套装置(装置如图所示),加入40 mL 1 mol·L-1的硫酸,测量收集10 mL H2所需的时间。
(2)取另一套装置,加入40 mL 4 mol·L-1的硫酸,测量收集10 mL H2所需的时间。
实验现象: 锌跟硫酸反应产生气泡,收集10 mL气体,(2)所用时间比(1)所用时间________(填“长”或“短”);
实验结论: 4 mol·L-1硫酸与锌反应比1 mol·L-1硫酸与锌反应速率______(填“大”或“小”)。
注意事项:① 锌粒的颗粒(即表面积)大小________________;
② 40 mL的硫酸要迅速加入;
③ 装置____________________,且计时要迅速准确;
④ 气体收集可以用排水量气装置代替。
实验讨论:除本实验测定反应速率的方法外,可行的方案还有(任写一种)
________________________________________________________________。
Ⅱ. 探究用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素,所用HNO3浓度为1.00 mol·L-1、2.00 mol·L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298 K、308 K。
请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
实验编号 | T(K) | 大理石规格 | HNO3浓度 (mol·L-1) | 实验目的 |
① | 298 | 粗颗粒 | 2.00 | (1)实验①和②探究HNO3浓度对该反应速率的影响 (2)实验①和_____探究温度对该反应速率的影响 (3)实验①和_____探究大理石规格(粗、细)对该反应速率的影响 |
② | _____ | ________ | _________ | |
③ | _____ | 粗颗粒 | _________ | |
④ | ______ | ______ | ________ |
【答案】短大基本相同气密性良好测定单位时间内产生H2的体积;(测定一段时间内H+的浓度变化;测定一定时间内锌粒质量变化)(任意一条即可)298粗颗粒1.003082.00298细颗粒2.00③④
【解析】
Ⅰ.(2) 稀硫酸和Zn可发生置换反应产生氢气,而气体产生在溶液中会以气泡的形式散发出来,故有气泡产生;反应物浓度越大,反应速率越快,所用时间就越短,即4mol·L-1的硫酸与锌反应速率较快,故(2)所用时间比(1)短 ;实验结论:4 mol·L-1硫酸与锌反应比1 mol·L-1硫酸与锌反应速率大;注意事项:① 固体表面积影响反应速率,锌粒的颗粒(即表面积)大小基本相同; ② 40 mL的硫酸要迅速加入;③ 检查装置气密性,装置不漏气,且计时要迅速准确;④ 气体收集可以用排水量气装置代替。实验讨论:测定实验的一些变量之间关系时一般可采用控制变量法,如控制时间相同,测定单位时间内产生氢气的体积;或测定一段时间内氢离子浓度变化;或测定一段时间内锌粒的质量变化;综上所述,本题答案是:短,大,基本相同,气密性良好;测定单位时间内产生H2的体积;(测定一段时间内H+的浓度变化;测定一定时间内锌粒质量变化)(任意一条即可)。
Ⅱ. 本实验是由实验①做对比实验探究影响反应速率的因素,所以在设计分组实验时,要设计出分别只有浓度、温度和接触面积不同时反应速率的变化,从而找出不同外界因素对反应速率的影响;
由于实验①②的温度、大理石规格相同,实验①和实验②探究的是HNO3浓度对该反应速率的影响,所以温度为298 K,大理石为粗颗粒,HNO3浓度为1.00 mol·L-1;
实验①③中只有温度不同,实验①和实验③就可以探究温度对该反应速率的影响,故实验③的温度选择308K;硝酸选2.00 mol·L-1;
实验①④中只有大理石规格不同,实验①和实验④可以探究接触面积对该反应速率的影响,故实验④选择细颗粒的大理石,温度为298,硝酸选2.00 mol·L-1;
综上所述,本题答案是:298 ,粗颗粒, 1.00, 308 , 2.00 , 298 , 细颗粒, 2.00,③,④。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】I 用Cl2生产某些含氯有机物时会产生副产物HCl,利用反应A可实现氯的循环利用。反应A:4HCl+O2![]() 2Cl2+2H2O。
2Cl2+2H2O。
已知:ⅰ反应A中,4 mol HCl被氧化,放出115.6 kJ的热量。
ⅱ.

(1)H2O的电子式是______________________。
(2)反应A的热化学方程式是_________________________________________________。
(3)断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为________ kJ,H2O中H—O键比HCl中H—Cl键________(填“强”或“弱”)。
II 在一定条件下,可逆反应A2(g) + B2(g) ![]() 2C(g)达到平衡时,各物质的平衡浓度c(A2)=0.5 mol·L-1、c(B2)=0.1 mol·L-1、c(C)=1.6 mol·L-1,若用a、b、c分别表示A2、B2、C的初始浓度(mol·L-1),则:
2C(g)达到平衡时,各物质的平衡浓度c(A2)=0.5 mol·L-1、c(B2)=0.1 mol·L-1、c(C)=1.6 mol·L-1,若用a、b、c分别表示A2、B2、C的初始浓度(mol·L-1),则:
(1)a、b应满足的关系是________________________________;
(2)a的取值范围是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(12分)现有反应:CO(g)+ H2O(g)![]() CO2(g)+ H2(g) ;△H<0。在850℃时,平衡常数K=1。
CO2(g)+ H2(g) ;△H<0。在850℃时,平衡常数K=1。
(1)若升高温度到950℃时,达到平衡时K__ ___1(填“>”、“<”或“=”)
(2)850℃时,若向一容积可变的密闭容器中同时充入 1.0 mol CO、3.0molH2O、1.0mol CO2和 x molH2,则:
①当x=5.0时,上述平衡向_______(填“正反应”或“逆反应”)方向进行。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是________。
(3)在850℃时,若设x=5.0 mol和x=6.0mol,其它物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则a _______ b(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按以下步骤从![]() 合成
合成![]() 。(部分试剂和反应条件已略去)
。(部分试剂和反应条件已略去)
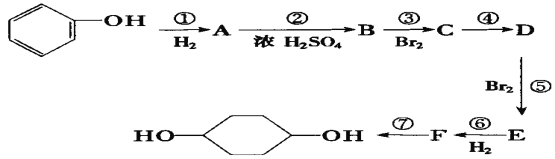
请回答下列问题:
(1)分别写出B、D的结构简式:B_________、D_________。
(2)反应①~⑦中属于消去反应的是_______________。(填数字代号)
(3)如果不考虑⑥、⑦反应,对于反应⑤,得到的E可能的结构简式为______________________ 、_____________________、_____________________。
(4)写出下列反应的化学方程式(并注明反应条件) A→B _________;C→D____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀:2Ba2++3OH-+Al3++2SO42-=2BaSO4↓+Al(OH)3↓
B. 用惰性电极电解AlCl3溶液产生白色沉淀:2Al3++6Cl-+6H2O![]() Al(OH)3↓+3H2↑+3Cl2↑
Al(OH)3↓+3H2↑+3Cl2↑
C. 用酸性K2Cr2O7溶液检验酒精:3CH3CH2OH+2Cr2O72-+2H2O=4Cr(OH)3↓+3CH3COO-+OH-
D. 用足量的氨水处理硫酸工业的尾气:SO2+NH3·H2O=NH4++HSO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据题意,完成下列各题:
(1)1.0 g乙醇完全燃烧生成液态水放出1.37 kJ热量,表示乙醇的燃烧热的热化学方程式为__________________________________________________;
(2) “长征”2号火箭的发动机中用“偏二甲肼”(分子式为C2H8N2)和四氧化二氮作为液态燃料。已知a g偏二甲肼与b g四氧化二氮在发动机内燃烧生成稳定的、对环境友好的物质。若生成1 mol N2(g) 的反应热为c kJ,写出热化学方程式______________________________________________;
(3) T ℃时,如图所示, 对应的化学方程式为______________________;
(4) 向足量的H2SO4溶液中加入100 mL 0.4 mol·L-1的Ba(OH)2溶液,放出的热量是5.12 kJ。向足量的Ba(OH)2溶液中加入100 mL 0.4 mol·L-1的HCl溶液,放出的热量为2.2 kJ。则Na2SO4溶液与BaCl2溶液反应的热化学方程式为Ba2+(aq)+SO42-(aq)===BaSO4(s) ΔH=______________;
(5) 研究表明,化学反应的能量变化(ΔH)与反应物和生成物的键能有关。键能可以简单地理解为断开1 mol化学键时所需吸收的能量。下表是部分化学键的键能数据:
化学键 | P—P | P—O | O==O | P==O |
键能kJ/mol | 197 | 360 | 499 | x |
已知白磷(P4)的燃烧热为2378.0 kJ/mol,白磷完全燃烧的产物(P4O10)的结构如图所示,则上表中x=_________________。


查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组利用下图装置制取乙酸乙酯,其中A盛浓硫酸,B盛乙醇、无水醋酸,D盛饱和碳酸钠溶液。
已知:
①氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH;
②几种有机物沸点:乙醚34.7℃,乙醇78.5℃,乙酸117.9℃,乙酸乙酯77.1℃;
③乙酸与乙醇反应生成酯的过程中酸分子断裂C-O键,醇分子断裂O—H键。

请回答:
(1)乙醇分子中官能团的名称是__________________。
(2)A的名称是_____________;浓硫酸的主要作用是作____________________。
(3)在B中加入几块碎瓷片的目的是_______;C除起冷凝作用外,另一重要作用是_____。
(4)若参加反应的乙醇为CH3CH2l8OH,请写出用该乙醇制乙酸乙酯的化学方程式__________;该反应类型为___________。
(5)D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,其净化过程如下:
ⅰ:加入无水氯化钙,去除_________________;
ⅱ:最好加入________(填字母序号)作吸水剂;
A 碱石灰 B 氢氧化钾 C 无水硫酸钠
ⅲ:蒸馏,收集77℃左右的馏分,得到较纯净的乙酸乙酯。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校活动小组为探究金属腐蚀的相关原理,设计了如下图a所示装置,图a的铁棒末段分别连上一块Zn片和Cu片,并静置于含有K3[Fe(CN)6]及酚酞的混合凝胶上。一段时间后发现凝胶的某些区域(如下图b所示)发生了变化。已知:3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓(蓝色)。则下列说法错误的是
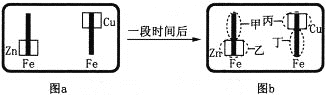
A. 甲区发生的电极反应式:Fe-2e-=Fe2+ B. 乙区产生Zn2+
C. 丙区呈现红色 D. 丁区呈现蓝色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据图示回答问题:
(1)化学反应N2+3H2===2NH3的能量变化如图所示,该反应的热化学方程式是______(填字母)。
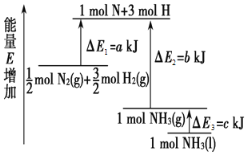
A.N2(g)+3H2(g)===2NH3(l)ΔH=2(a-b-c)kJ·mol-1
B. N2(g)+3H2(g)===2NH3(g)ΔH=2(b-a)kJ·mol-1
C.1/2N2(g)+3/2H2(g)===NH3(l)ΔH=(b+c-a) kJ·mol-1
D.1/2N2(g)+3/2H2(g)===NH3(g)ΔH=(a+b)kJ·mol-1
(2)如图是N2和H2反应生成2 mol NH3过程中能量变化的示意图,请计算每生成1 mol NH3放出的热量为__________________________。
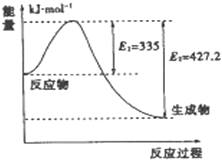
(3)2SO2(g)+O2(g)===2SO3(g)反应过程的能量变化如图所示。
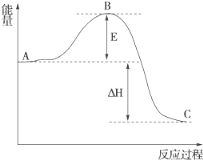
已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ·mol-1。
①图中A、C分别表示________、________,E的大小对该反应的反应热有无影响?___________________________________。
②图中ΔH=________kJ·mol-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com