
| ①H2O |
| CO2+H2O |
| ②△ |
| ||
| ||


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.068 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
| 催化剂 |
| 实验编号 | T(0C) | NO初始浓度 (mol/L) | CO初始浓度 (mol/L) | 催化剂的比 表面积(m2/g) |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | a | b | c | 124 |
| Ⅲ | 350 | d | e | 124 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力.
能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力.查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
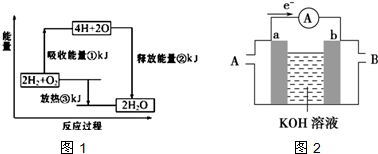
查看答案和解析>>
科目:高中化学 来源: 题型:
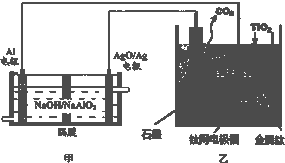
| A、甲装置工作过程中OH-向AgO/Ag极移动;乙装置工作过程中O2-向阴极移动 | ||
| B、乙装置阳极的电极反应式为C+2O2--4e-═CO2↑ | ||
C、若电解金属钛效率为η,则获取1mol Ti时消耗Al的物质的量
| ||
| D、在制备金属钛前后,整套装置中CaO的总量减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硅酸钠的水溶液俗称水玻璃,是制备硅胶和木材防火剂等的原料 |
| B、将钢闸门与外加电源负极相连,可防止钢闸门被腐蚀 |
| C、CaO能与SO2反应,可作工业废气的脱硫剂 |
| D、MgO、Al2O3都是常见的耐高温材料,工业上也常用其电解冶炼对应的金属 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com