
【题目】①热分解法、②热还原法、③电解法是工业上制取金属的三种常用方法。下列金属与冶炼方法相对应的是( )
选项 | 金属 | 冶炼方法 |
A | K、Na | ③ |
B | Ca、Cu | ② |
C | Fe、Mg | ③ |
D | Al、Hg | ① |
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
【题目】把任意比的NaHCO3和Na2O2的混合物放在密闭容器中加热.关于混合物加热前后消耗盐酸的物质的量,下列结论判断正确的是( )
A.加热前后一样多 B.加热前消耗的多
C.加热后消耗的多 D.当Na2O2适量时才会一样多无法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家利用“组合转化”等技术对CO2进行综合利用。如用H2 和CO2在一定条件下可以合成乙烯:6H2(g)+2CO2(g)![]() C2H4 (g)+4H2O(g) △H= a kJ/mol
C2H4 (g)+4H2O(g) △H= a kJ/mol
(1)已知:①H2和C2H4的燃烧热分别为285.8kJ/mol和1411kJ/mol
②H2O(g)= H2O(l) △H= - 44 kJ/mol
则a= kJ/mol。
(2)不同温度对CO2的转化率及催化剂的效率影响如图所示,下列有关说法错误的是 ____________(填序号)。
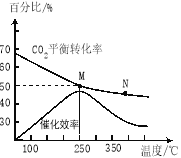
①M点的速率最大
②温度低于250℃时,随温度升高乙烯的产率增大
③M点时平衡常数比N点时平衡常数大
④为提高 CO2的转化率应在尽可能低的温度下进行反应
(3)若在密闭容器中充入体积比为 3∶1的H2和CO2,则图中M点时,产物C2H4的体积分数为 ;若要进一步提高乙烯的体积分数,可采取的措施有 。
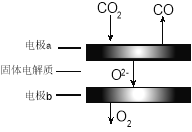
(4)利用高温电解技术可将CO2转化为高热值的燃料CO气体。
① 电极a发生的反应类型是 (填“氧化”或“还原”)反应。
② 高温电解的总反应的化学方程式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学化学常见的有机化合物A(C6H6O)是重要的化工原料,在工业上能合成紫外线吸收剂BAD和治疗心脏病药物的中间体F,合成路线如下:

已知:BAD的结构简式为: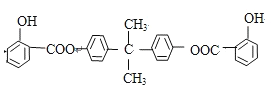
F的结构简式为: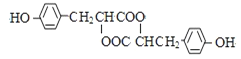
试回答:
(1)H中含有的官能团名称是 .
(2)写出X的结构简式 ,推测B的核磁共振氢谱中显示有 种不同化学环境的氢原子.
(3)写出反应类型 C→D ;E→F .
(4)1mol C与浓溴水反应,最多可以消耗 molBr2.
(5)C→D的过程中可能有另一种产物C1,请写出C1在加热条件下与足量稀NaOH水溶液
反应的化学方程式: .
(6)W的同分异构体有下列性质:与FeCl3反应,溶液呈紫色;能发生银镜反应;则该同
分异构体共有 种.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铁的氧化物(FexO)1.52g溶于足量盐酸中,向所得溶液中通入标准状况下112mlCl2,恰好将Fe2+完全氧化。x值为
A.0.80 B.0.85 C.0.90 D.0.93
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解一定浓度的CuSO4溶液时,通电一段时间后,向所得的溶液中加入0.1 mol Cu2(OH)2CO3后,恰好恢复到电解前的浓度和pH(不考虑二氧化碳的溶解)。则电解过程中转移的电子的物质的量为( )
A. 0.4 mol B. 0.5 mol
C. 0.6 mol D. 0.8 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】唐代刘禹锡撰于818年的传信方中有这样一段描述“治气痢巴石丸,取白矾一大斤。以炭火净地烧令汁尽,则其色如雪,谓之巴石”。据此推测,用于治气痢巴石丸,其主要原料的化学成分为
A.CuSO4 B.FeSO4﹒7H2O C.KAl(SO4)2﹒7H2O D.Fe2(SO4)3﹒7H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.6mol锌粉跟过量盐酸反应,在一定温度下,为加快反应速率但又不影响生成氢气的总量,可向反应混合物中加入适量的
A.铜粉 B.醋酸锌溶液 C.氯化铜固体 D.二氧化锰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A.同系物一定符合同一通式
B.同分异构体一定具有相同的最简式
C.相对分子质量相等的两种有机物必定是同分异构体
D.同分异构体间不一定有相似的化学性质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com