
 学业测评一课一测系列答案
学业测评一课一测系列答案 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
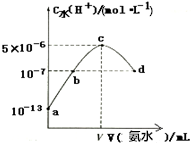 常温下,向20mL某浓度的硫酸中滴入0.1mol•L-1氨水,溶液中水电离出的氢离子浓度随加入氨水的体积变化如图所示.下列分析正确是( )
常温下,向20mL某浓度的硫酸中滴入0.1mol•L-1氨水,溶液中水电离出的氢离子浓度随加入氨水的体积变化如图所示.下列分析正确是( )| A. | 该硫酸的浓度为1mol•L-1 | |
| B. | b点所示溶液中:c(NH4+)=2c(SO42-) | |
| C. | V=40 | |
| D. | c点所示溶液中:c(H+)-c(OH-)═c(NH3•H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{1}{2}$ | B. | $\frac{1}{3}$ | C. | $\frac{1}{4}$ | D. | $\frac{1}{5}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
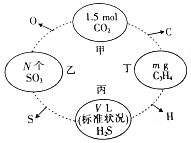 如图,两相邻圆圈内物质间含有相同的某一原子,且该原子的物质的量相同.(设NA为阿伏伽德罗常数的值)
如图,两相邻圆圈内物质间含有相同的某一原子,且该原子的物质的量相同.(设NA为阿伏伽德罗常数的值)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在和上面初始体积相同的恒温恒压密闭容器中,也充入0.5molN2和1.5molH2发生反应则达到平衡时,放出的热量大于46.2kJ | |
| B. | 在平衡时再充入1molNH3则平衡向左移动,则平衡时N2的百分含量减小 | |
| C. | 若向容器中充入一定量He气,则平衡向右移动 | |
| D. | 在平衡后再充入1molH2,则N2的转化率增大,且平衡常数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能使淀粉碘化钾试纸显蓝色的溶液:Na+、H+、I-、SO32- | |
| B. | 饱和CO2的溶液中:Ca2+、K+、NO3-、Cl- | |
| C. | 在pH=14的溶液中:Na+、K+、Cl-、SO2 | |
| D. | 无色透明溶液:Na+、Ba2+、MnO4-、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com