
| A. | 能使淀粉碘化钾试纸显蓝色的溶液:Na+、H+、I-、SO32- | |
| B. | 饱和CO2的溶液中:Ca2+、K+、NO3-、Cl- | |
| C. | 在pH=14的溶液中:Na+、K+、Cl-、SO2 | |
| D. | 无色透明溶液:Na+、Ba2+、MnO4-、Cl- |
分析 A.能使淀粉碘化钾试纸显蓝色的溶液,具有氧化性;
B.饱和CO2的溶液,显酸性;
C.pH=14的溶液,显碱性;
D.MnO4-为紫色.
解答 解:A.能使淀粉碘化钾试纸显蓝色的溶液,具有氧化性,分别与I-、SO32-发生氧化还原反应不能共存,故A不选;
B.饱和CO2的溶液,显酸性,该组离子之间不反应,可大量共存,故B选;
C.pH=14的溶液,显碱性,不能大量存在SO2,故C不选;
D.MnO4-为紫色,与无色不符,故D不选;
故选B.
点评 本题考查离子共存,为高频考点,把握习题中的信息及离子之间的反应为解答本题的关键,侧重分析与应用能力的考查,注意复分解反应、氧化还原反应的判断,题目难度不大.


科目:高中化学 来源: 题型:解答题
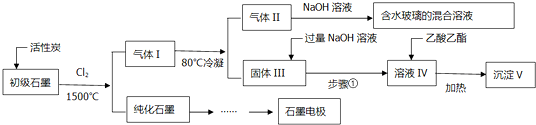
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | Na+ | Mg2+ | Al3+ |
| 浓度/mol•L-1 | 0.5 | 1.0 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A、C的氧化物均含离子键 | |
| B. | C离子的半径小于D离子的半径 | |
| C. | A、B可形成多种原子个数比为1:1的化合物 | |
| D. | 含D元素的盐溶液只能显碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Fe3+、SO42-、Cl- | B. | NH4+、Mg2+、SO42- | ||
| C. | NH4+、Cl-、SO42- | D. | NH4+、Al3+、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温下SiO2(s)+2C(s)=Si(s)+2CO(g)不能自发进行,则该反应的△H>0 | |
| B. | 常温下,NH4Cl溶液加水稀释$\frac{c(N{H}_{3}•{H}_{2}O)•c({H}^{+})}{c(N{{H}_{4}}^{+})}$不变 | |
| C. | 向硅酸钠溶液中滴加酚酞,溶液变红,证明了Na2SiO3发生了水解 | |
| D. | 如图可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化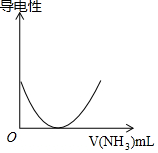 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com