
����Ŀ�������£���20mL ��Һ����ȡ��ˮ����ƿ�У���0.05moL/LHCl��Һ�ζ�����pH�Ʋɼ����ݣ����Ի��Ƶĵζ���������ͼ��ʾ������˵����ȷ����

A. ��pH=11.0ʱ��NH3H2O�ĵ���ƽ�ⳣ��Kb=1.78��10-5
B. ��pH=9.0 ʱ��c(Cl-)>c(NH4+ )>c(OH-) >c(H+)
C. ��pH= 5.5ʱ����Һ����5 ����
D. ��pH= 7.0 ʱ����ˮ��HCl ��Һǡ����ȫ��Ӧ
���𰸡�A
��������A��谱ˮ���ʵ���Ũ��Ϊxmol/L��pH=11.0ʱc��OH-��=c��NH4+��=1![]() 10-3mol/L����ʱc��NH3��H2O��=xmol/L-c��NH4+��
10-3mol/L����ʱc��NH3��H2O��=xmol/L-c��NH4+��![]() xmol/L�����ݵ���ƽ�ⳣ���ĸ���ó���c��OH-����c��NH4+��=Kb��c��NH3��H2O����1
xmol/L�����ݵ���ƽ�ⳣ���ĸ���ó���c��OH-����c��NH4+��=Kb��c��NH3��H2O����1![]() 10-3
10-3![]() 1
1![]() 10-3=Kbx����ʽ����pH=7.0ʱ����22.40mLHCl����ʱ��Һ�еĵ���غ�Ϊc��NH4+��+c��H+��=c��OH-��+c��Cl-����pH=7.0��c��H+��=c��OH-��=1
10-3=Kbx����ʽ����pH=7.0ʱ����22.40mLHCl����ʱ��Һ�еĵ���غ�Ϊc��NH4+��+c��H+��=c��OH-��+c��Cl-����pH=7.0��c��H+��=c��OH-��=1![]() 10-7mol/L����c��NH4+��=c��Cl-��=
10-7mol/L����c��NH4+��=c��Cl-��=![]() mol/L�����������غ��ʱc��NH3��H2O��=��
mol/L�����������غ��ʱc��NH3��H2O��=��![]() -
-![]() ��mol/L=
��mol/L=![]() mol/L�����ݵ���ƽ�ⳣ��ֻ���¶��йأ���Ũ���أ�1
mol/L�����ݵ���ƽ�ⳣ��ֻ���¶��йأ���Ũ���أ�1![]() 10-7
10-7![]() =Kb
=Kb![]() ����ʽ����������ʽ����ʽ���x=0.05632��Kb=1.78
����ʽ����������ʽ����ʽ���x=0.05632��Kb=1.78![]() 10-5��A����ȷ��B������������Һ��һ�����ڵ���غ�c��NH4+��+c��H+��=c��OH-��+c��Cl-����pH=9.0ʱc��OH-��
10-5��A����ȷ��B������������Һ��һ�����ڵ���غ�c��NH4+��+c��H+��=c��OH-��+c��Cl-����pH=9.0ʱc��OH-��![]() c��H+������c��Cl-��
c��H+������c��Cl-��![]() c��NH4+����B�����C�pH=5.5ʱ����Һ�д��ڵ�����NH4+��Cl-��H+��OH-��NH3��H2O��H2O��C�����D���ˮ������ǡ����ȫ��Ӧ����NH4Cl��NH4Cl����ǿ�������Σ�NH4Cl��Һ�����ԣ�pH=7.0ʱ��ˮ������D�����ѡA��
c��NH4+����B�����C�pH=5.5ʱ����Һ�д��ڵ�����NH4+��Cl-��H+��OH-��NH3��H2O��H2O��C�����D���ˮ������ǡ����ȫ��Ӧ����NH4Cl��NH4Cl����ǿ�������Σ�NH4Cl��Һ�����ԣ�pH=7.0ʱ��ˮ������D�����ѡA��


 �п�������㾫��ϵ�д�
�п�������㾫��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij������Ԫ��Q��ԭ�������ֻ��һ�����ӣ�����˵����ȷ���ǣ� ��
A. Qһ������±���γɹ��ۼ� B. Qһ������±���γ����Ӽ�
C. Q�ĵ����в����ڻ�ѧ�� D. Q����Ԫ���γɵĻ������п��ܺ��й��ۼ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1995��ŵ������ѧ�������������о�����㱻�ƻ��������λ������ѧ�ң������еij�������˳������������ߣ����������ϵ�������ﰺ����CCl2F2�����ڹ�������·ֽ⣬����Clԭ�ӣ�Clԭ�ӻ�Գ�����������õ��ƻ����ã������ķ���ʽΪO3�����йط�ӦΪO3 ![]() O2+O��Cl+O3��ClO+O2
O2+O��Cl+O3��ClO+O2
ClO+O��Cl+O2���ܷ�Ӧ��2O3��3O2
��1��������������������ķ�Ӧ�����У�Cl��
A.��Ӧ��
B.������
C.����
D.����
��2��O3��O2��
A.ͬ���칹��
B.ͬϵ��
C.����ͬ��������
D.����ͬλ�أ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijС���о�Na2S ��Һ��KMnO4��Һ��Ӧ��̽����������
ʵ����� | I | II |
ʵ����� |
|
|
ʵ������ | ��ɫ��dz��pH | ��Һ�ʵ���ɫ��pH |
����: i.MnO4-��ǿ���������±���ԭΪMn2+���ڽ����������±���ԭΪMnO2
ii.�����������������Һ����Һ�ʵ���ɫ��
����˵����ȷ����
A. ����ʵ���֪��Na2S����ԭ
B. ȡʵ��I��������Һ����ʵ�飬����SO42-���ó�S2-��������SO42-
C. ʵ��I�з�Ӧ���ӷ���ʽ: 2MnO4-+3Mn2++2H2O=5MnO2��+4H+
D. ʵ��II �з�Ӧ��������Һ�ʵ���ɫ����MnO2����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������������������Ҫװ����ͼA��ʾ����Ҫ�������a�Թ��а�2��3��2�����������Ũ���ᡢ�Ҵ�������Ļ����ڰ�Aͼ����װ�ã�ʹ����������������ͨ��b�Թ���ʢ�ı���̼������Һ(���뼸�η�̪��Һ)�У���С�����a�Թ��еĻ��Һ���ܵ�b�Թ����ռ���Լ2 mL����ʱֹͣ���ȡ�����b�Թܲ�������Ȼ���ô�����Һ��ֲ㣻�ݷ��������������������
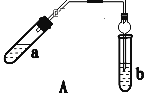
��ش��������⣺
(1) ������пɹ۲쵽b�Թ�����ϸС������ð����д���÷�Ӧ�����ӷ���ʽ��___��
(2) Aװ����ʹ�����ιܳ������������⣬��һ��Ҫ������___��������з���������������ʹ�õ�һ��������___��
(3) Ϊ֤��Ũ�����ڸ÷�Ӧ�����˴�������ˮ�������ã�ijͬѧ������ͼA��ʾװ�ý���������4��ʵ�顣ʵ�鿪ʼ���þƾ�����3min���ټ���ʹ֮����3min��ʵ�����������С�Թ�b�ٲ��л���ĺ�ȣ�ʵ���¼���£�
ʵ�� ��� | �Թ�a���Լ� | �Թ�b���Լ� | ����л���ĺ��/cm |
A | 3 mL�Ҵ���2 mL���ᡢ1mL 18mol��L-1Ũ���� | ����Na2CO3��Һ | 5.0 |
B | 3 mL�Ҵ���2 mL���� | 0.1 | |
C | 3 mL�Ҵ���2 mL���ᡢ6 mL 3mol��L-1H2SO4 | 1.2 | |
D | 3 mL�Ҵ���2 mL���ᡢ���� | 1.2 |
��ʵ��D��Ŀ������ʵ��C����գ�֤��H+��������Ӧ���д����á�ʵ��D��Ӧ��������������Ũ�ȷֱ���__mL��___mol��L-1��
�ڷ���ʵ��___(��ʵ����)�����ݣ������Ʋ��ŨH2SO4����ˮ����������������IJ��ʡ�Ũ�������ˮ���ܹ���������������ʵ�ԭ����___��
�ۼ���������������������IJ��ʣ���ʵ�鷢���¶ȹ������������IJ��ʷ������ͣ����ܵ�ԭ����___��
�ܷ�����������������ϴ�ӣ�Ϊ�˸�������������ѡ�õĸ����Ϊ__ (����ĸ)��
A.P2O5B.��ˮNa2SO4C.��ʯ��D.NaOH����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л����ķ�����ᴿ�����У���Ҫ���Ǵ����ʵ��ܽ��ԽǶȿ��ǵ��ǣ� ��
A.����
B.����
C.�ᾧ
D.��ȡ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CyrneineA��������ϵͳ�������źܺõ���Ч���Ʊ�CyrneineA��������ͪ�����ಽ��Ӧ�ϳɣ�����˵������ȷ���ǣ�������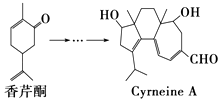
A.����ͪ��ѧʽΪC10H14O
B.CyrneineA���Է����ӳɷ�Ӧ����ȥ��Ӧ��������Ӧ
C.����ͪ��CyrneineA����ʹ����KMnO4��Һ��ɫ
D.������ͪ��Ϊͬ���칹�壬��������4�ֲ�ͬ��ѧ��������ԭ�ӵķ�����ﹲ��4��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и����е��������ʲ����Ժ��ֱ�����ϣ�ֻҪ�����������ʵ���һ��������ȫȼ������O2���������ֲ������( )
A. C2H4��C2H6O B. C2H6��C2H6O C. C3H6��C2H4 D. C3H4��C2H6O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����÷�����X��ϩ��Y���Ժϳ����������ռ�BAD��
��֪��G���ܷ���������Ӧ��B��FeCl3��Һ����ɫ��C��D�Ĺ���Ϊ�����Ȼ�����COOH���ķ�Ӧ������BAD�ṹ��ʽΪ�� 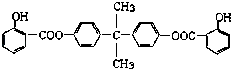
BAD�ĺϳ�·�����£�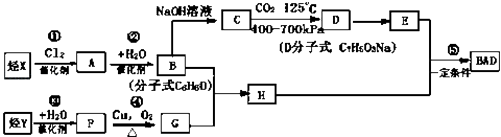
�Իش��������⣺
��1��д���ṹ��ʽYD ��
��2�����ڼӳɷ�Ӧ���У���������ţ� ��
��3��1molBAD�����뺬molNaOH����Һ��ȫ��Ӧ��
��4��д������ʽ��Ӧ�� �� F+E ��
��5��E�ж���ͬ���칹�壬�жϷ�������Ҫ���ͬ���칹����ĿΪ�֣�
���ܷ���������Ӧ����FeCl3��Һ����ɫ�ۺ˴Ź�������ͼ�����ĸ����շ壮
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com