
【题目】实验室制乙酸乙酯得主要装置如图A所示,主要步骤①在a试管中按2∶3∶2的体积比配制浓硫酸、乙醇、乙酸的混合物;②按A图连接装置,使产生的蒸气经导管通到b试管所盛的饱和碳酸钠溶液(加入几滴酚酞试液)中;③小火加热a试管中的混合液;④等b试管中收集到约2 mL产物时停止加热。撤下b试管并用力振荡,然后静置待其中液体分层;⑤分离出纯净的乙酸乙酯。
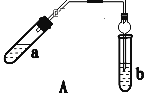
请回答下列问题:
(1) 步骤④中可观察到b试管中有细小的气泡冒出,写出该反应的离子方程式:___。
(2) A装置中使用球形管除起到冷凝作用外,另一重要作用是___,步骤⑤中分离乙酸乙酯必须使用的一种仪器是___。
(3) 为证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用如图A所示装置进行了以下4个实验。实验开始先用酒精灯微热3min,再加热使之微微沸腾3min。实验结束后充分振荡小试管b再测有机层的厚度,实验记录如下:
实验 编号 | 试管a中试剂 | 试管b中试剂 | 测得有机层的厚度/cm |
A | 3 mL乙醇、2 mL乙酸、1mL 18mol·L-1浓硫酸 | 饱和Na2CO3溶液 | 5.0 |
B | 3 mL乙醇、2 mL乙酸 | 0.1 | |
C | 3 mL乙醇、2 mL乙酸、6 mL 3mol·L-1H2SO4 | 1.2 | |
D | 3 mL乙醇、2 mL乙酸、盐酸 | 1.2 |
①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是__mL和___mol·L-1。
②分析实验___(填实验编号)的数据,可以推测出浓H2SO4的吸水性提高了乙酸乙酯的产率。浓硫酸的吸水性能够提高乙酸乙酯产率的原因是___。
③加热有利于提高乙酸乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,可能的原因是___。
④分离出乙酸乙酯层后,经过洗涤,为了干燥乙酸乙酯可选用的干燥剂为__ (填字母)。
A.P2O5B.无水Na2SO4C.碱石灰D.NaOH固体
【答案】 2CH3COOH+CO32-![]() 2CH3COO-+H2O+CO2↑ 防止倒吸 分液漏斗 6 6 AC 浓硫酸可以吸收酯化反应中生成的水,降低了生成物浓度使平衡向生成乙酸乙酯的方向移动 大量乙酸、乙醇未经反应就脱离反应体系(或温度过高发生其他反应) B
2CH3COO-+H2O+CO2↑ 防止倒吸 分液漏斗 6 6 AC 浓硫酸可以吸收酯化反应中生成的水,降低了生成物浓度使平衡向生成乙酸乙酯的方向移动 大量乙酸、乙醇未经反应就脱离反应体系(或温度过高发生其他反应) B
【解析】(1)碳酸钠与醋酸反应生成二氧化碳气体。
(2)A装置中使用球形管除起到冷凝作用外,球形结构可防止液体倒吸;步骤⑤中乙酸乙酯与碳酸钠溶液分层,利用分液法分离。
(3)①对比实验关键是要采用控制变量,即控制一个变量,其它条件不变。
②分析使用浓硫酸和稀硫酸的实验,比较哪种条件下生成的乙酸乙酯多。
③乙酸、乙醇易挥发,温度过高会发生其它反应,据此回答。
④根据乙酸乙酯能够在酸性条件下、碱性条件下发生水解反应的性质进行分析。
(1)步骤④中可观察到b试管中有细小的气泡冒出,该反应的离子方程式为2CH3COOH+CO32-![]() 2CH3COO-+H2O+CO2↑;正确答案: 2CH3COOH+CO32-
2CH3COO-+H2O+CO2↑;正确答案: 2CH3COOH+CO32-![]() 2CH3COO-+H2O+CO2↑。
2CH3COO-+H2O+CO2↑。
(2)A装置中使用球形管除起到冷凝作用外,另一重要作用是防止倒吸;步骤⑤中分离乙酸乙酯必须使用的一种仪器是分液漏斗;正确答案:防止倒吸;分液漏斗。
(3)①本题是研究实验D与实验C相对照,证明氢离子对酯化反应具有催化作用的条件,题中采用了一个变量,实验C中3mol·L-1H2SO4,实验D盐酸,所以达到实验目的,实验D与实验C中氢离子的浓度一样,实验C中3 mL乙醇、2 mL乙酸、6 mL 3mol·L-1H2SO4;实验D中:3 mL乙醇、2 mL乙酸、盐酸要保证溶液体积一致,才能保证乙醇、乙酸的浓度不变,盐酸体积为6mL,实验D与实验C中H+的浓度一样,所以盐酸的浓度为6mol·L-1;正确答案:6,6。
②对照实验A和C可以知道:试管Ⅰ中试剂实验A中使用1mL 18mol·L-1浓硫酸,生成的乙酸乙酯比C中生成的乙酸乙酯大很多,说明浓硫酸的吸水性提高了乙酸乙酯的产率;正确答案:AC,浓硫酸可以吸收酯化反应中生成的水,降低了生成物浓度使平衡向生成乙酸乙酯的方向移动。
③乙酸、乙醇易挥发,温度过高大量乙酸、乙醇未经反应就脱离反应体系,且温度过高发生其他反应,导致产率降低;正确答案:大量乙酸、乙醇未经反应就脱离反应体系或温度过高发生其它反应。
④P2O5遇水能生成磷酸,乙酸乙酯在酸性条件下会发生水解,不能用P2O5干燥乙酸乙酯,A错误;无水硫酸钠吸水形成硫酸钠结晶水合物,无水硫酸钠和乙酸乙酯不反应,用无水硫酸钠除去乙酸乙酯中少量的水,B正确;碱石灰属于碱性干燥剂,乙酸乙酯在碱性条件下会发生水解,不能用碱石灰干燥乙酸乙酯,C错误;NaOH固体是强碱,乙酸乙酯在碱性条件下会发生水解,不能用NaOH固体干燥乙酸乙酯,D错误;正确选项B。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下图是部分短周期主族元素原子半径与原子序数的关系图。下列说法错误的是 ( )
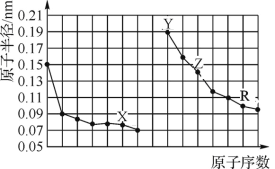
A. X、Y两种单质在常温下反应生成的产物为碱性氧化物
B. Z制成的槽车可以密封贮运R的氧化物对应的水化物
C. Y、Z、R三种元素最高价氧化物对应水化物相互之间可以发生反应
D. 电解熔融的X与Z组成的化合物可以得到单质Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知碳碳单键可绕键轴自由旋转,某烃的结构简式如图所示,下列说法中正确的是
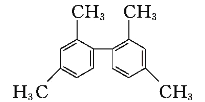
A. 该物质所有原子均可共面
B. 分子中至少有10个碳原子处于同一平面上
C. 分子中至少有11个碳原子处于同一平面上
D. 该有机物苯环上的一溴代物有6种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增大。m、p、q、r、s是由这些元素组成的二元化合物,常温常压下r为液体,其余均为无色气体,m的摩尔质量为p的2倍,n是元素Y的单质,q能使品红溶液褪色。上述的转化关系如图所示。下列说法中不正确的是
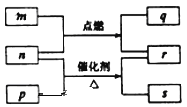
A. 原子半径:W<Y<X
B. 非金属性:Y>X>W
C. m与q、n与s均不能共存
D. 若n过量,q还可以继续燃烧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用20mL 移液管移取氨水至锥形瓶中,用0.05moL/LHCl溶液滴定。用pH计采集数据,电脑绘制的滴定曲线如下图所示。下列说法正确的是

A. 当pH=11.0时,NH3H2O的电离平衡常数Kb=1.78×10-5
B. 当pH=9.0 时,c(Cl-)>c(NH4+ )>c(OH-) >c(H+)
C. 当pH= 5.5时,溶液中有5 种微粒
D. 当pH= 7.0 时,氨水和HCl 溶液恰好完全反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物在工农业生产有着重要的用途,氯化铜、氯化业铜经常用作催化剂。其中CuCl广泛应用于化工和印染等行业。
【查阅资料】(i)氯化铜:从水溶液中结晶时,在15℃以下得到四水物,在15-25.7℃得到三水物,在26~42℃得到二水物,在42℃以上得到一水物,在100得到无水物。
(ii)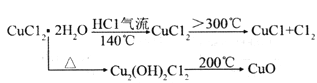
(1)实验室用如图所示的实验仪器及药品制备纯净、干燥的氧气并与铜反应(铁架台,铁夹略)制备氯化铜。
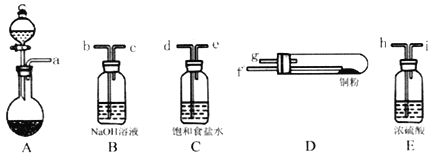
①按气流方向连接各仪器接口顺序是:
a→_____、_____→_____、_____→_____、_____→_____。
②本套装置有两个仪器需要加热,加热的顺序为先_____后_______
(2)印刷电路板是由高分子材料和铜箔复合而成,刻制印刷电路时,要用FeCl3溶液作为“腐蚀液”,写出该反应的化学方程式:_____________________。
(3)现欲从(2)所得溶液获得纯净的CuCl22H2O,进行如下操作:
①首先向溶液中加入H2O2溶液然后再加试剂X用于调节pH,过滤,除去杂质,X可选用下列试剂中的(填序号)
a.NaOH b.NH3H2O C.CuO d.CuSO4
②要获得纯净CuCl22H2O晶体的系列操作步骤为:向①所得滤液中加少量盐酸,蒸发浓缩、_____、_____、洗涤、干燥。
(4)用CuCl22H2O为原料制备CuCl时,发现其中含有少量的CuCl2或CuO杂质,若杂质是CuCl2,则产生的原因是______________。
(5)设计简单的实验验证0.1mol/L的CuCl2溶液中的Cu2+对H2O2的分解具有催化作用:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,已知醋酸的电离常数Ka=1.6×10-5,醋酸银的溶度积Ksp(CH3COOAg)=3.7×10-3。下列有关说法正确的是
A. 醋酸溶液中,c(CH3COO-)>c(H+)>c(OH-)
B. 将相同浓度的CH3COOH溶液与CH3COO Na溶液等体积混合,所得溶液呈碱性
C. 该温度下,1mol/L的醋酸溶液中,醋酸的电离度为0.4%
D. 该温度下,浓度均为0.02mol/L的CH3COONa溶液和AgNO3溶液等体积混合(忽略混合后溶液体积的变化),有CH3COOAg沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,向10mL.0.1mol/LCaCl2溶液中滴加0.1mol/L的Na2CO3溶液。滴加过程中溶液中-1gc(Ca2+)与Na2CO3溶液体积(V)的关系如图所示,下列有关说法正确的是( )
(已知1g5=0.7)

A. x、y两点c(Ca2+)之比为2000:3 B. Ksp(CaCO3)=5×10-9
C. w点对应的分散系很稳定 D. x、y、z三点中,水的电离程度最大的为x点
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com