
【题目】下图是部分短周期主族元素原子半径与原子序数的关系图。下列说法错误的是 ( )
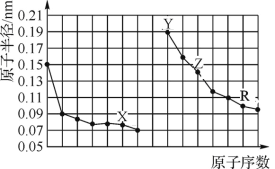
A. X、Y两种单质在常温下反应生成的产物为碱性氧化物
B. Z制成的槽车可以密封贮运R的氧化物对应的水化物
C. Y、Z、R三种元素最高价氧化物对应水化物相互之间可以发生反应
D. 电解熔融的X与Z组成的化合物可以得到单质Z
科目:高中化学 来源: 题型:
【题目】某学生血液化验单中“葡萄糖”的结果为5.04×10﹣3molL﹣1 . 这里的“5.04×10﹣3 molL﹣1”表示葡萄糖的( )
A.物质的量
B.摩尔质量
C.质量分数
D.物质的量浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用下列装置进行乙醇催化氧化的实验。

(1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学方程式__________、__________。
(2)甲和乙两个水浴作用不相同。甲的作用是__________,乙的作用是__________。
(3)反应进行一段时间后,试管a中能收集到不同的物质,它们是__________;集气瓶中收集到的气体的主要成分是__________。
(4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还有__________。要除去该物质,可先在混合液中加入__________(填写字母),然后再通过蒸馏即可除去。
A.氯化钠溶液 B.苯 C.碳酸氢钠溶液 D.四氯化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第一代半导体材料(Si、Ge等)与第二代半导体材料(GaAs、InSb等)一起,将人类推进了信息时代。近年来,以碳化硅(SiC)、氮化镓(GaN)为代表的第三代半导体材料的出现,开辟了人类资源和能源节约型社会的新发展,也成为了科学家研究的热点。
(1)N、P、AS位于同一主族,基态氮原子的核外共有___种不同运动状态的电子,N2O的空间构型为_______。
(2)酞菁钴近年来在光电材料、非线性光学材料、光动力学中的光敏剂、催化剂等方面得到广泛的应用,其结构如图所示,中心离子为钴离子。酞菁钻中碳原子的杂化轨道类型为___;与钴离子通过配位健结合的氮原子的编号是_______。

(3)C与N处于同周期相邻元素,C形成的一种重要物质可燃冰是天然气水合物,具有笼形结构如图A(表面的小球是水分子,内部的大球是甲烷分子)。图A中最小的环中连接的原子总数是_______。可燃冰晶体具有多种笼状结构,其中一种由1个图A所示笼分别用2个面与另外两个相同的笼共面而成,则中间笼实际占有____个水分子。

(4)已知PH3分子的键角约为94%,而AsH3分子的键角约为91.8°,试用价层电子对互斥理论解释PH3的键角比AsH3的键角大的原因________________。
(5)第三周期主族元素中,按第一电离能大小排序,第一电离能在磷和铝之间的元素有____。
(6)氮化硼、氮化铝、氮化镓的结构类似于金刚石,熔点如表中所示;试从结构的角度分析它们熔点不同的原因__________________。
物质 | BN | AIN | GaN |
熔点/℃ | 3000 | 2200 | 1700 |
(7)磷化铝晶胞如图所示,若两个铝原子之间的最近距离为dpm,NA代表阿伏加德罗常数的值,则磷化铝晶体的密度p=_____g/cm3。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某短周期元素Q的原子最外层只有一个电子,下列说法正确的是( )
A. Q一定能与卤素形成共价键 B. Q一定能与卤素形成离子键
C. Q的单质中不存在化学键 D. Q与氧元素形成的化合物中可能含有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四种元素中,其第一电离能最大的是 ( )
A. 原子含有未成对电子最多的第二周期元素 B. 位于周期表中第三周期ⅢA族的元素
C. 原子最外层电子排布为2s22p4的元素 D. 原子最外层电子排布为3s23p3的元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在某密闭容器中发生反应:2HI(g)![]() H2(g)+I2(g) ΔH>0,若15s内c(HI)由0.1mol·L-1降到0.07mol·L-1,则下列说法正确的是( )
H2(g)+I2(g) ΔH>0,若15s内c(HI)由0.1mol·L-1降到0.07mol·L-1,则下列说法正确的是( )
A. 0~15 s内用I2表示的平均反应速率为v(I2)=0.002 mol·L-1·s-1
B. c(HI)由0.07 mol·L-1降到0.05 mol·L-1所需的反应时间小于10 s
C. 升高温度正反应速率加快,逆反应速率减慢
D. 减小反应体系的体积,化学反应速率加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制乙酸乙酯得主要装置如图A所示,主要步骤①在a试管中按2∶3∶2的体积比配制浓硫酸、乙醇、乙酸的混合物;②按A图连接装置,使产生的蒸气经导管通到b试管所盛的饱和碳酸钠溶液(加入几滴酚酞试液)中;③小火加热a试管中的混合液;④等b试管中收集到约2 mL产物时停止加热。撤下b试管并用力振荡,然后静置待其中液体分层;⑤分离出纯净的乙酸乙酯。
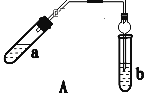
请回答下列问题:
(1) 步骤④中可观察到b试管中有细小的气泡冒出,写出该反应的离子方程式:___。
(2) A装置中使用球形管除起到冷凝作用外,另一重要作用是___,步骤⑤中分离乙酸乙酯必须使用的一种仪器是___。
(3) 为证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用如图A所示装置进行了以下4个实验。实验开始先用酒精灯微热3min,再加热使之微微沸腾3min。实验结束后充分振荡小试管b再测有机层的厚度,实验记录如下:
实验 编号 | 试管a中试剂 | 试管b中试剂 | 测得有机层的厚度/cm |
A | 3 mL乙醇、2 mL乙酸、1mL 18mol·L-1浓硫酸 | 饱和Na2CO3溶液 | 5.0 |
B | 3 mL乙醇、2 mL乙酸 | 0.1 | |
C | 3 mL乙醇、2 mL乙酸、6 mL 3mol·L-1H2SO4 | 1.2 | |
D | 3 mL乙醇、2 mL乙酸、盐酸 | 1.2 |
①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是__mL和___mol·L-1。
②分析实验___(填实验编号)的数据,可以推测出浓H2SO4的吸水性提高了乙酸乙酯的产率。浓硫酸的吸水性能够提高乙酸乙酯产率的原因是___。
③加热有利于提高乙酸乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,可能的原因是___。
④分离出乙酸乙酯层后,经过洗涤,为了干燥乙酸乙酯可选用的干燥剂为__ (填字母)。
A.P2O5B.无水Na2SO4C.碱石灰D.NaOH固体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com