
【题目】下列四种元素中,其第一电离能最大的是 ( )
A. 原子含有未成对电子最多的第二周期元素 B. 位于周期表中第三周期ⅢA族的元素
C. 原子最外层电子排布为2s22p4的元素 D. 原子最外层电子排布为3s23p3的元素
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下图的各方框表示有关的一种反应物或生成物(某些物质已经略去),其中常温下A、C、D为无色气体,C能使湿润的红色石蕊试纸变蓝。
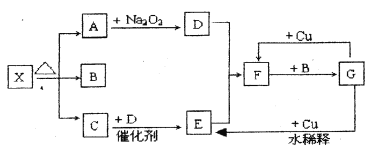
(1)C的电子式:_________________________;F的化学式:__________________________;
(2)写出下列变化的离子方程式或化学方程式:
G→E(离子方程式):_________________________________________________________;
A→D(化学方程式):_________________________________________________________;
(3)实验室制取气体C的化学方程式为___________________________________________,常采用____________________________法来收集气体C。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组对2-溴丙烷与NaOH溶液发生的反应进行探究,实验装置如下(夹持和加热装置已略去):
实验步骤:
ⅰ.将圆底烧瓶用水浴加热,冷凝管中通入冷凝水;
ⅱ.将分液漏斗中的2-溴丙烷与NaOH溶液的混合液滴入圆底烧瓶内。
(1)水冷凝管a口是(填“进水口”或“出水口”)。
(2)取具支试管中收集到的液体,经红外光谱检测,其中一种物质中存在C-O键和O-H键。则该物质的结构简式是。
(3)实验中酸性KMnO4溶液褪色,生成该使酸性KMnO4溶液褪色的物质的反应的化学方程式是。
(4)通过该实验得到的结论是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期主族元素原子半径与原子序数的关系图。下列说法错误的是 ( )
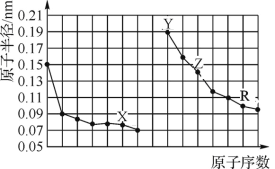
A. X、Y两种单质在常温下反应生成的产物为碱性氧化物
B. Z制成的槽车可以密封贮运R的氧化物对应的水化物
C. Y、Z、R三种元素最高价氧化物对应水化物相互之间可以发生反应
D. 电解熔融的X与Z组成的化合物可以得到单质Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2和H2在催化剂表面合成氨的微观历程及能量变化的示意图如下,用![]() 、
、![]() 、
、![]() 分别表示N2、H2、NH3,下列说法正确的是
分别表示N2、H2、NH3,下列说法正确的是

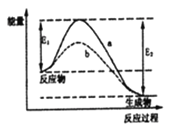
A. 使用催化剂,合成氨反应放出的热量减少
B. 在该过程中,N2、H2断键形成N原子和H原子
C. 在该过程中,N原子和H原子形成了含有非极性键的NH3
D. 合成氨反应中,反应物断键吸收能量大于生成物形成新键释放的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y两元素可形成X2Y3型化合物,则X、Y原子最外层的电子排布可能是( )。
A. X:3s23p1Y:3s23p5 B. X:3s2Y:2s22p3
C. X:3s23p1Y:3s23p3 D. X:2s22p3Y:2s22p4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物在工农业生产有着重要的用途,氯化铜、氯化业铜经常用作催化剂。其中CuCl广泛应用于化工和印染等行业。
【查阅资料】(i)氯化铜:从水溶液中结晶时,在15℃以下得到四水物,在15-25.7℃得到三水物,在26~42℃得到二水物,在42℃以上得到一水物,在100得到无水物。
(ii)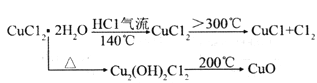
(1)实验室用如图所示的实验仪器及药品制备纯净、干燥的氧气并与铜反应(铁架台,铁夹略)制备氯化铜。
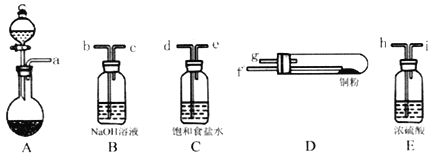
①按气流方向连接各仪器接口顺序是:
a→_____、_____→_____、_____→_____、_____→_____。
②本套装置有两个仪器需要加热,加热的顺序为先_____后_______
(2)印刷电路板是由高分子材料和铜箔复合而成,刻制印刷电路时,要用FeCl3溶液作为“腐蚀液”,写出该反应的化学方程式:_____________________。
(3)现欲从(2)所得溶液获得纯净的CuCl22H2O,进行如下操作:
①首先向溶液中加入H2O2溶液然后再加试剂X用于调节pH,过滤,除去杂质,X可选用下列试剂中的(填序号)
a.NaOH b.NH3H2O C.CuO d.CuSO4
②要获得纯净CuCl22H2O晶体的系列操作步骤为:向①所得滤液中加少量盐酸,蒸发浓缩、_____、_____、洗涤、干燥。
(4)用CuCl22H2O为原料制备CuCl时,发现其中含有少量的CuCl2或CuO杂质,若杂质是CuCl2,则产生的原因是______________。
(5)设计简单的实验验证0.1mol/L的CuCl2溶液中的Cu2+对H2O2的分解具有催化作用:_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com