
【题目】当光束通过下列分散系:①尘埃的空气 ②稀硫酸 ③蒸馏水 ④墨水,能观察到有丁达尔现象的是( )
A.①②
B.②③
C.①④
D.②④
科目:高中化学 来源: 题型:
【题目】航天飞船高速进入大气层后,温度会迅速升高,其表层的复合材料可保护飞船不受破坏。这体现了该复合材料具有的特点是
A. 耐酸性 B. 耐热性 C. 耐腐蚀 D. 耐碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体A的化学式为NH5,它的所有原子的最外层都符合相应的稀有气体原子的最外层电子层结构,则下列有关说法中,不正确的是( )
A. NH5的电子式为![]()
B. NH5中既有共价键又有离子键,NH5是离子化合物
C. 1 mol NH5中含有5NA个N—H键(NA表示阿伏加德罗常数)
D. 它与水反应的化学方程式为NH5+H2O===NH3·H2O+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第一代半导体材料(Si、Ge等)与第二代半导体材料(GaAs、InSb等)一起,将人类推进了信息时代。近年来,以碳化硅(SiC)、氮化镓(GaN)为代表的第三代半导体材料的出现,开辟了人类资源和能源节约型社会的新发展,也成为了科学家研究的热点。
(1)N、P、AS位于同一主族,基态氮原子的核外共有___种不同运动状态的电子,N2O的空间构型为_______。
(2)酞菁钴近年来在光电材料、非线性光学材料、光动力学中的光敏剂、催化剂等方面得到广泛的应用,其结构如图所示,中心离子为钴离子。酞菁钻中碳原子的杂化轨道类型为___;与钴离子通过配位健结合的氮原子的编号是_______。

(3)C与N处于同周期相邻元素,C形成的一种重要物质可燃冰是天然气水合物,具有笼形结构如图A(表面的小球是水分子,内部的大球是甲烷分子)。图A中最小的环中连接的原子总数是_______。可燃冰晶体具有多种笼状结构,其中一种由1个图A所示笼分别用2个面与另外两个相同的笼共面而成,则中间笼实际占有____个水分子。

(4)已知PH3分子的键角约为94%,而AsH3分子的键角约为91.8°,试用价层电子对互斥理论解释PH3的键角比AsH3的键角大的原因________________。
(5)第三周期主族元素中,按第一电离能大小排序,第一电离能在磷和铝之间的元素有____。
(6)氮化硼、氮化铝、氮化镓的结构类似于金刚石,熔点如表中所示;试从结构的角度分析它们熔点不同的原因__________________。
物质 | BN | AIN | GaN |
熔点/℃ | 3000 | 2200 | 1700 |
(7)磷化铝晶胞如图所示,若两个铝原子之间的最近距离为dpm,NA代表阿伏加德罗常数的值,则磷化铝晶体的密度p=_____g/cm3。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】维尔纳配合物M是一种橙黄色单斜晶体。该晶体以浓氨水、双氧水、CoCl26H2O、NH4Cl 为原料在加热条件下通过活性炭的催化来合成。为探究该晶体的组成,设计了如下实验:
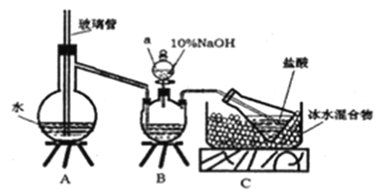
步骤一,氮的测定:准确称取一定量橙黄色晶体,加入适量水溶解,注入下图所示的三预瓶中,然后逐滴加入足量10%NaOH溶液,通入 水蒸气,将样品中的氨全部蒸出,用500.00mL7.0mol /L的盐酸溶液吸收,吸收结束后量取吸收液25.00mL,用2.00mol/L的NaOH溶液滴定过量的盐酸,终点消耗NaOH溶液12.50mL。
步骤二,氯的测定: 准确称取橙黄色晶体wg,配成溶液后用AgNO3标准溶液滴定,以K2CrO4溶液为指示剂,至出现淡红色沉淀不再消失为终点(Ag2CrO4为砖红色沉淀)。
(1)装置B中仪器a的名称为_______。
(2)裝置A、B 三脚架处应放置一个酒精灯作为热源,酒精灯应放置在___(填“A”或“B”) 处。
(3) 步骤一所称取的样品中含氮的质量为_______g。
(4)有同学提出装置C中所用盐酸的浓度过大易挥发,会造成测得氮的含量结果将____ (填“偏高”、“偏低”或“无影响”); 冰水混合物的作用是________。
(5) 测定氯的过程中,使用棕色滴定管的原因是_______; 出现浅红色沉淀时,若溶液中c(CrO42-)=0.0025mol/L,通过计算说明该实验可以使用K2CrO4溶液为指示剂的原因______ (呈现计算过程)。已知: Ksp(Ag2CrO4)=1.0×10-12 Kp(AgCl)=1.8×10-10
(6)经上述实验测定,配合物M中钻、氮、氯的物质的量之比为1: 6: 3,其中氮元素以氨的形式存在。制备M的化学方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四种元素中,其第一电离能最大的是 ( )
A. 原子含有未成对电子最多的第二周期元素 B. 位于周期表中第三周期ⅢA族的元素
C. 原子最外层电子排布为2s22p4的元素 D. 原子最外层电子排布为3s23p3的元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可由乙苯生产苯乙烯:![]() ,下列说法正确的是
,下列说法正确的是
A. 该反应的类型为消去反应
B. 乙苯的同分异构体共有三种
C. 可用酸性高锰酸钾溶液鉴别乙苯和苯乙烯
D. 乙苯和苯乙烯分子内共平面的碳原子数均为7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国“海狼”号潜艇上的核反应堆内使用了液体铝钠合金作载热介质,下列关于Al、Na原子结构的分析中正确的是( )
A. 原子半径:Al>Na
B. 第一电离能:Al>Na
C. 电负性:Na>Al
D. 基态原子未成对电子数:Na>Al
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸渣是用黄铁矿制造硫酸过程中排出的废渣,主要化学成分为SiO2(约45%)、Fe2O3(约40%)、Al2O3 (约10%)和MgO(约5%)。其同学设计了如下方案,分离样品中各种金属元素。
已知: Fe(OH)3的Ksp=4.0×10-38。请回答下列问题。
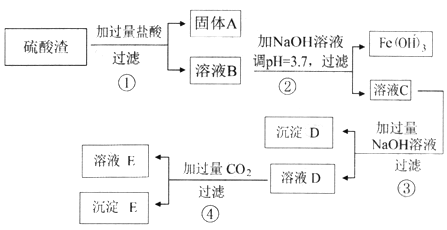
(1) 固体A的一种工业应用________;沉淀D的电子式___________。
(2) 溶液B中所含的金属阳离子有___________。(写离子符号)
(3) 若步骤②中调pH 为3.0,则溶液C中的Fe3+ 是否沉淀完全,通过计算说明______。
(4) 写出步骤④中全部反应的离子方程式_______________。
(5) 为了分析某硫酸渣中铁元素的含量,先将硫酸渣预处理,把铁元索还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定。
①判断到达滴定终点的现象是__________。
②某同学称取2.000g硫酸渣,预处理后在容量瓶中配制成100mL 溶液,移取25.00mL 试样溶液,用0.0050 mol/L KMnO4标准溶液滴定,达到滴定终点时,消耗标准溶液20.00mL,则残留物中铁元素的质量分数是_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com