
【题目】某温度下,已知醋酸的电离常数Ka=1.6×10-5,醋酸银的溶度积Ksp(CH3COOAg)=3.7×10-3。下列有关说法正确的是
A. 醋酸溶液中,c(CH3COO-)>c(H+)>c(OH-)
B. 将相同浓度的CH3COOH溶液与CH3COO Na溶液等体积混合,所得溶液呈碱性
C. 该温度下,1mol/L的醋酸溶液中,醋酸的电离度为0.4%
D. 该温度下,浓度均为0.02mol/L的CH3COONa溶液和AgNO3溶液等体积混合(忽略混合后溶液体积的变化),有CH3COOAg沉淀生成
【答案】C
【解析】醋酸溶液存在电离平衡:CH3COOH![]() CH3COO-+H+和H2O
CH3COO-+H+和H2O![]() H++OH-,从中可知:c(H+)>c(CH3COO-) >c(OH-),A错误;CH3COO Na溶液水解平衡常数为Kh=KW/Ka=10-14/1.6×10-5=6.25×10-10,而CH3COOH的电离常数Ka=1.6×10-5,所以醋酸的电离能力大于醋酸钠的水解能力,因此将相同浓度的CH3COOH溶液与CH3COONa溶液等体积混合,所得溶液呈酸性,B错误;根据电离方程式CH3COOH
H++OH-,从中可知:c(H+)>c(CH3COO-) >c(OH-),A错误;CH3COO Na溶液水解平衡常数为Kh=KW/Ka=10-14/1.6×10-5=6.25×10-10,而CH3COOH的电离常数Ka=1.6×10-5,所以醋酸的电离能力大于醋酸钠的水解能力,因此将相同浓度的CH3COOH溶液与CH3COONa溶液等体积混合,所得溶液呈酸性,B错误;根据电离方程式CH3COOH![]() CH3COO-+H+,假设1mol/L的醋酸溶液中,醋酸的电离度为0.4%,即有4×10-3 mol/L CH3COOH分子发生电离,产生的氢离子和醋酸根离子的浓度均为4×10-3 mol/L ,则醋酸的电离常数Ka=c(H+)×c(CH3COO-)/ c(CH3COOH)= 4×10-3×4×10-3/(1- 4×10-3)= 1.6×10-5,与题给醋酸平衡常数相同,C正确;溶液等体积混合,混合后c(CH3COO-)=0.01 mol/L,c(Ag+)=0.01 mol/L,根据CH3COOAg浓度商= c(Ag+)×c(CH3COO-)=0.01×0.01=1×10-4 <Ksp(CH3COOAg)=3.7×10-3,所以没有沉淀产生,D错误;正确选项C。
CH3COO-+H+,假设1mol/L的醋酸溶液中,醋酸的电离度为0.4%,即有4×10-3 mol/L CH3COOH分子发生电离,产生的氢离子和醋酸根离子的浓度均为4×10-3 mol/L ,则醋酸的电离常数Ka=c(H+)×c(CH3COO-)/ c(CH3COOH)= 4×10-3×4×10-3/(1- 4×10-3)= 1.6×10-5,与题给醋酸平衡常数相同,C正确;溶液等体积混合,混合后c(CH3COO-)=0.01 mol/L,c(Ag+)=0.01 mol/L,根据CH3COOAg浓度商= c(Ag+)×c(CH3COO-)=0.01×0.01=1×10-4 <Ksp(CH3COOAg)=3.7×10-3,所以没有沉淀产生,D错误;正确选项C。


科目:高中化学 来源: 题型:
【题目】一定温度下,在某密闭容器中发生反应:2HI(g)![]() H2(g)+I2(g) ΔH>0,若15s内c(HI)由0.1mol·L-1降到0.07mol·L-1,则下列说法正确的是( )
H2(g)+I2(g) ΔH>0,若15s内c(HI)由0.1mol·L-1降到0.07mol·L-1,则下列说法正确的是( )
A. 0~15 s内用I2表示的平均反应速率为v(I2)=0.002 mol·L-1·s-1
B. c(HI)由0.07 mol·L-1降到0.05 mol·L-1所需的反应时间小于10 s
C. 升高温度正反应速率加快,逆反应速率减慢
D. 减小反应体系的体积,化学反应速率加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制乙酸乙酯得主要装置如图A所示,主要步骤①在a试管中按2∶3∶2的体积比配制浓硫酸、乙醇、乙酸的混合物;②按A图连接装置,使产生的蒸气经导管通到b试管所盛的饱和碳酸钠溶液(加入几滴酚酞试液)中;③小火加热a试管中的混合液;④等b试管中收集到约2 mL产物时停止加热。撤下b试管并用力振荡,然后静置待其中液体分层;⑤分离出纯净的乙酸乙酯。
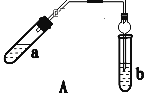
请回答下列问题:
(1) 步骤④中可观察到b试管中有细小的气泡冒出,写出该反应的离子方程式:___。
(2) A装置中使用球形管除起到冷凝作用外,另一重要作用是___,步骤⑤中分离乙酸乙酯必须使用的一种仪器是___。
(3) 为证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用如图A所示装置进行了以下4个实验。实验开始先用酒精灯微热3min,再加热使之微微沸腾3min。实验结束后充分振荡小试管b再测有机层的厚度,实验记录如下:
实验 编号 | 试管a中试剂 | 试管b中试剂 | 测得有机层的厚度/cm |
A | 3 mL乙醇、2 mL乙酸、1mL 18mol·L-1浓硫酸 | 饱和Na2CO3溶液 | 5.0 |
B | 3 mL乙醇、2 mL乙酸 | 0.1 | |
C | 3 mL乙醇、2 mL乙酸、6 mL 3mol·L-1H2SO4 | 1.2 | |
D | 3 mL乙醇、2 mL乙酸、盐酸 | 1.2 |
①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是__mL和___mol·L-1。
②分析实验___(填实验编号)的数据,可以推测出浓H2SO4的吸水性提高了乙酸乙酯的产率。浓硫酸的吸水性能够提高乙酸乙酯产率的原因是___。
③加热有利于提高乙酸乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,可能的原因是___。
④分离出乙酸乙酯层后,经过洗涤,为了干燥乙酸乙酯可选用的干燥剂为__ (填字母)。
A.P2O5B.无水Na2SO4C.碱石灰D.NaOH固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CyrneineA对治疗神经系统疾病有着很好的疗效,制备CyrneineA可用香芹酮经过多步反应合成:下列说法不正确的是( )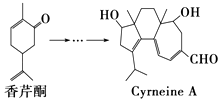
A.香芹酮化学式为C10H14O
B.CyrneineA可以发生加成反应、消去反应和氧化反应
C.香芹酮和CyrneineA均能使酸性KMnO4溶液褪色
D.与香芹酮互为同分异构体,分子中有4种不同化学环境的氢原子的酚类化合物共有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在有机合成中,常会将官能团消除或增加,下列相关过程中反应类型及相关产物不合理的是( )
A.乙烯 乙二醇: 
B.溴乙烷 乙醇:CH3CH2Br ![]() CH2═CH2
CH2═CH2 ![]() CH3CH2OH
CH3CH2OH
C.1﹣溴丁烷 1,3﹣丁二烯: 
D.乙烯 乙炔: 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项中的两种物质不论以何种比例混合,只要混合物的总物质的量一定,则完全燃烧消耗O2的质量保持不变的是( )
A. C2H4、C2H6O B. C2H6、C2H6O C. C3H6、C2H4 D. C3H4、C2H6O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列卤代烃在KOH醇溶液中加热不反应的是( )
①C6H5Cl ②(CH3)2CHCH2Cl ③(CH3)3CCH2Cl ④CHCl2﹣CHBr2 ⑤ ![]() ⑥CH2Cl2 .
⑥CH2Cl2 .
A.①③⑥
B.②③⑤
C.全部
D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】.高效净水剂聚合氯化铝铁(PAFC)的组成可表示为[AlFe(OH)nCl6-n]m,该物质广泛应用于日常生活用水和工业废水的处理。某工厂欲以工业废料(金属铝、铁及其氧化物)为原料制取PAFC,设计如下流程:

(1)PAFC中铁元素的化合价为_________。
(2)废料与稀盐酸混合后发生了多个化学反应,在发生的这些反应中,请写出一个是氧化还原反应但不属于四大基本反应类型的反应的离子方程式______________________________。
(3)所得酸性溶液中,不能确定是否一定存在的阳离子是___________,欲确认该离子是否存在最常用的试剂名称为____________________。
(4)试剂X最好是下列中的__________
A.Fe B.HNO3 C.氯水 D.高锰酸钾溶液
(5)水解形成的聚合物分散在水中的粒子直径在1nm~100nm之间,请用简单的实验操作验证该分散系 ____________________________________________________________________________。
Ⅱ.为检测PAFC中Al和Fe含量,采用如图所示流程进行。
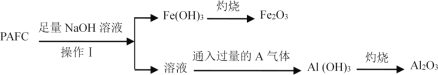
回答下列问题:
(6)操作I的名称______________________。
(7)通入过量的A气体的离子方程式为 ______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com