
【题目】已知A为淡黄色固体,R和T是两种生活中常见的金属单质,C、F是无色无味的气体。
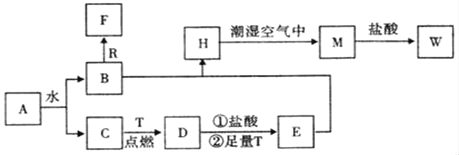
(1)物质A的化学式为_____,D化学式为_____,W的化学式为_____;
(2)B与R反应生成F的离子反应式为___________;
(3)A与CO2反应的化学反应方程式为____________;
(4)H转化为M的化学反应方程式为_____________;
【答案】Na2O2 Fe3O4 FeCl3 2Al+2OH﹣+2H2O=2AlO﹣2+3H2↑ 2Na2O2+2CO2=2Na2CO3+O2 4Fe(OH)2+O2+2H2O=4Fe(OH)3
【解析】
A为淡黄色固体,能与水反应,即A为Na2O2,Na2O2与水反应:2Na2O2+2H2O=4NaOH+O2↑,C为无色无味的气体,即C为O2,B为NaOH,R为常见金属单质,即R为Al,F为无色无味气体,即F为H2,T为两种生活中常见的金属单质,即T为Fe,D为Fe3O4,E为FeCl2,H为Fe(OH)2,M为Fe(OH)3,W为FeCl3;
A为淡黄色固体,能与水反应,即A为Na2O2,Na2O2与水反应:2Na2O2+2H2O=4NaOH+O2↑,C为无色无味的气体,即C为O2,B为NaOH,R为常见金属单质,即R为Al,F为无色无味气体,即F为H2,T为两种生活中常见的金属单质,即T为Fe,D为Fe3O4,Fe3O4与盐酸反应生成FeCl2和FeCl3,加入过量的Fe,Fe与FeCl3反应生成FeCl2,即E为FeCl2,H为Fe(OH)2,M为Fe(OH)3,W为FeCl3,
(1)根据上述分析,物质A为Na2O2,D的化学式为Fe3O4,W的化学式为FeCl3;
(2)Al与NaOH溶液反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3)Na2O2与CO2反应的方程式为2Na2O2+2CO2=2Na2CO3+O2;
(4)Fe(OH)2被氧气氧化成Fe(OH)3,其反应方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.氧化还原反应的本质是元素化合价的升降
B.氯化钠溶液在电流的作用下电离产生Na+、Cl-
C.强电解质溶液的导电能力一定比弱电解质溶液的导电能力强
D.得到电子的物质被还原,元素化合价降低,体现氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K2Cr2O7溶液中存在平衡:Cr2O72-(橙色) ![]() 2CrO42-(黄色)+2H+ 。用K2Cr2O7溶液进行下列实验,结合实验,下列说法不正确的是( )
2CrO42-(黄色)+2H+ 。用K2Cr2O7溶液进行下列实验,结合实验,下列说法不正确的是( )
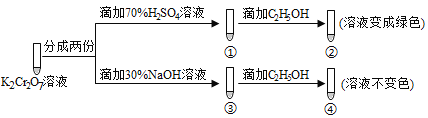
A. ①中溶液橙色加深,③中溶液变黄 B. ②中Cr2O72-被C2H5OH还原
C. 若向④中加入70%H2SO4溶液至过量,溶液变为橙色 D. 对比②和④可知K2Cr2O7酸性溶液氧化性强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用石灰水保存鲜蛋是一种化学保鲜法。石灰水能保存鲜蛋的原理是
①石灰具有强碱性,杀菌能力强;
②Ca(OH)2能与鲜蛋呼出的CO2反应,生成碳酸钙薄膜,起保护作用;
③石灰水是电解质溶液,能使蛋白质凝聚;
④石灰水能渗入蛋内中和酸性物质。
A. ①②B. ③④C. ②④D. ①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某实验小组对H2O2的分解做了如下探究。下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同的粉末状和块状的MnO2分别加入盛有15 ml 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5min |
块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30min |
(1)写出上述实验中发生反应的化学方程式: 。
(2)实验结果表明,催化剂的催化效果与 有关。
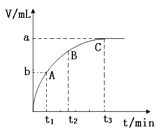
(3)某同学在10 mL H2O2 溶液中加入一定量的二氧化锰,放出气体的体积(标准状况)与反应时间的关系如图所示,则A、B、C三点所表示的反应速率最慢的是 。
Ⅱ.某反应在体积为5L的恒容密闭容器中进行, 在0-3分钟内各物质的量的变化情况如右下图所示(A,B,C均为气体,且A气体有颜色)。
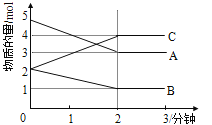
(4)该反应的的化学方程式为 。
(5)反应开始至2分钟时,B的平均反应速率为 。
(6)能说明该反应已达到平衡状态的是 。
a.v(A)= 2v(B) b.容器内各物质的物质的量相等
c.v逆(A)=v正(C) d.容器内气体的颜色保持不变
(7)由图求得平衡时A的转化率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生产硫酸的主要反应:2SO2(g)+O2(g)![]() 2SO3(g)△H<0。图中L(L1、L2)、X可分别代表压强或温度。下列说法正确的是
2SO3(g)△H<0。图中L(L1、L2)、X可分别代表压强或温度。下列说法正确的是
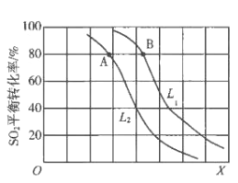
A. X代表压强
B. 推断L1>L2
C. A、B两点对应的平衡常数相同
D. 一定温度下,当混合气中n(SO2):n(O2):n(SO3)=2:1:2,则反应一定达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 1 mol H2O的质量为18g/mol
B. CH4的摩尔质量为16g
C. 3.01×1023个SO2分子的质量为32g
D. 标准状况下,1 mol任何物质体积均为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:
① | ||||||||
② | ③ | |||||||
④ | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)④在周期表中的位置是______,③的最简单氢化物的电子式______。
(2)②、⑥、⑧对应的最高价含氧酸的酸性由强到弱的顺序是______(填化学式)。
(3)①、②、③三种元素形成的化合物M中原子个数比为4∶2∶3,M中含有的化学键类型有______。
(4)能说明⑦的非金属性比⑧的非金属性______(填“强”或“弱”)的事实是______(用一个化学方程式表示)。
(5)⑤、⑧两元素最高价氧化物对应水化物相互反应的离子方程式为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com