
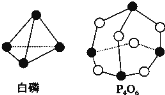
【题目】已知白磷和P4O6的分子结构如下图所示,现提供以下化学键的键能:P-P:198kJ/mol,P-O:360kJ/mol,O=O:498kJ/mol,则反应P4(白磷)+3O2=P4O6的能量变化为( )
A. 放出热量1638kJB. 吸收热量1638kJ
C. 放出热量126kJD. 吸收热量126kJ
【答案】A
【解析】
反应热△H=反应物总键能-生成物总键能,据此计算判断,注意每摩尔P4中含有6molP-P键。
P-P:198kJ/mol,P-O:360kJ/mol,O=O:498kJ/mol,反应热△H=反应物总键能-生成物总键能,由图可知:1个P分子中含有6个P-P,1个P4O6分子中含有12个P-O,1mol P4和3molO2完全反应(P4+3O2=P4O6)生成1molP4O6,所以反应P4+3O2=P4O6的反应热△H=6×kJ/mol +3×498 kJ/mol -12×360 kJ/mol =-1638k kJ/mol,即该反应发生时放热1638kJ,故合理选项是A。


科目:高中化学 来源: 题型:
【题目】下列示意图与对应的反应情况符合的是
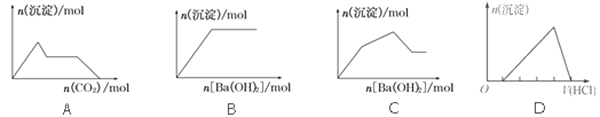
A. 向含0.01 mol KOH和0.01 mol Ca(OH)2的混合溶液中缓慢通入CO2至过量
B. 向NaHSO4溶液中逐滴加入Ba(OH)2溶液至过量
C. 向KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液至过量
D. 向含有少量氢氧化钠的NaAlO2溶液中逐滴加入盐酸至过量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某反应A(g)+B(g)=C(g)+D(g),过程中的能量变化如图所示,下列说法中正确的是( )
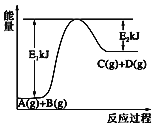
A. A的能量一定低于C
B. 反应物断键吸收的总能量大于产物新键形成放出的总能量
C. 化学反应中的能量变化都表现为热量的变化
D. 1mol气体A和1mol气体B反应生成1mol气体C和1molD
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~H八种短周期主族元素在周期表中的相对位置如下图所示,已知C元素形成的单质有“国防金属”的美誉,E的最高价氧化物对应的水化物能与E的最简单氢化物反应生成离子化合物。
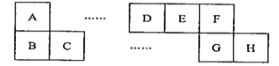
(1)D元素在周期表中的位置为______________。
(2)B、E、F的简单离子半径由大到小的顺序为______________(写离子符号)。
(3)上述元素所形成的气态单质中能用于饮用水消毒的是_________(写化学式)。
(4)F与G的氢化物中稳定的是________(写化学式)。
(5)B的单质在F的单质中燃烧所形成化合物的电子式为________。
(6)写出实验室制备E的最简单氢化物的化学方程式_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下实验能获得成功的是( )
A.用酸性高锰酸钾溶液鉴别乙烯和乙炔
B.将稀硫酸、稀硝酸和苯混合加热制硝基苯
C.苯和硝基苯混合物采用分液的方法分离
D.用氢氧化钠溶液除去溴苯中含有的杂质溴
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表短周期的一部分:

请按要求用化学用语回答下列问题:
(1)元素④、⑥、⑨的离子半径由大到小的顺序为________________;
(2)元素②、③、④的简单氢化物的沸点由低到高的顺序: _____________________;
(3)用电子式表示元素④与元素⑥形成的化合物的形成过程____________;
(4)比元素⑦的原子序数多17的元素在周期表的位置为________________;
(5)写出由①④⑤三种元素组成的一种离子化合物的电子式_______________,若将其溶于水,破坏了其中的__________(填“离子键”、“共价键”或“离子键和共价键”);
(6)元素①和元素④形成的化合物及元素①和元素⑧形成的化合物均为18电子分子,请写出这两种化合物按物质的量之比4:1反应的离子方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】震惊全国的天津港“8.12”爆炸事故中,因爆炸冲击导致氰化钠泄漏而造成环境污染,可以通过喷洒双氧水或硫代硫酸钠溶液来处理。
资料:氰化钠化学式NaCN(N元素-3价),白色结晶颗粒,剧毒,易溶于水
(1)NaCN用双氧水处理后,产生一种酸式盐和一种能使湿润红色石蕊试纸变蓝的气体,写出该反应的化学方程式________________。
(2)某化学兴趣小组实验室制备硫代硫酸钠(Na2S2O3),并检测用硫代硫酸钠溶液处理后的氰化钠废水能否达标排放。
【实验一】实验室通过下图装置制备Na2S2O3。
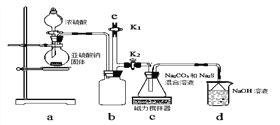
①a装置中盛浓硫酸的仪器名称是_______________;
b装置的作用是________________。
②c装置中的产物有Na2S2O3和CO2等,d装置中的溶质有NaOH、Na2CO3,还可能有___________________。
③实验结束后,在e处最好连接盛_________(选填“NaOH溶液”、“水”、“CCl4”中任一种)的注射器,再关闭K2打开K1,目的是__________________
【实验二】测定用硫代硫酸钠溶液处理后的废水中氰化钠的含量。
已知:
① 废水中氰化钠的最高排放标准为0.50 mg/L。
② Ag++2CN- = [ Ag (CN)2]-, Ag++I- = AgI↓, AgI呈黄色,且CN-优先与Ag+反应。
实验如下:
取25.00 mL处理后的氰化钠废水于锥形瓶中,并滴加几滴KI溶液作指示剂,用1.000 ×10-4 mol/L的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为2.50 mL。
④滴定终点的判断方法是____________________
⑤处理后的废水中氰化钠的含量为__________mg/L,_______(选填“能”、“不能”)排放
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温、容积为2L的密闭容器中通入1 mol X和2 mol Y,发生反应:X(g)+2Y(g)![]() M(g) ΔH=-a kJ/mol(a>0),5 min末测得M的物质的量为0.4 mol。则下列说法正确的是
M(g) ΔH=-a kJ/mol(a>0),5 min末测得M的物质的量为0.4 mol。则下列说法正确的是
A. 0~5 min,X的平均反应速率为0.08 mol·L-1·min-1
B. 0~5 min,Y的平均反应速率为0.08 mol·L-1·min-1
C. 平衡后升高温度,X的反应速率降低
D. 到达平衡状态时,反应放出的热量为a kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空气质量报告中涉及的污染物主要是( )
A.Cl2、HCl 、酸雨B.SO2、NO2、可吸入颗粒物
C.NH3、CO、CO2D.SO2、N2、可吸入颗粒物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com