
【题目】某兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化。
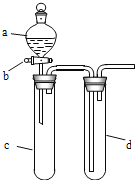
(1)实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c,其目的是_______________________________。
(2)在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入2 mL浓硝酸,c中反应的化学方程式是__________________________________。
(3)下表是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是________。
方案 | 反应物 |
甲 | Cu、浓HNO3 |
乙 | Cu、稀HNO3 |
丙 | Cu、O2、稀HNO3 |
(4)该小组还用上述装置进行实验证明酸性:HCl>H2CO3>H2SiO3,则分液漏斗a中加入的试剂是________,c中加入的试剂是________,d中加入的试剂是________;实验现象为________________。
【答案】 检查装置气密性 Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O 丙 稀盐酸 大理石(或Na2CO3固体) Na2SiO3溶液 c中有气泡产生,d中生成白色胶状物质(或白色沉淀)
【解析】分析:(1)实验前要检查装置气密性;
(2)浓硝酸和铜反应生成硝酸铜、二氧化氮和水;
(3)根据反应中是否产生污染性气体以及反应物利用率是否达到100%分析;
(4)根据强酸制备弱酸的原理分析。
详解:(1)实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c.其目的是检查装置的气密性;
(2)浓硝酸和铜反应生成硝酸铜、二氧化氮和水,反应的化学方程式为. Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;
(3)方案甲是铜和浓硝酸反应生成硝酸铜,二氧化氮和水,有污染气体生成,不能体现绿色化学理念;方案乙是稀硝酸和铜反应生成硝酸铜,一氧化氮和水,有污染气体生成,不能体现绿色化学理念;丙是利用铜和氧气反应生成氧化铜,氧化铜和硝酸反应生成硝酸铜,反应过程中无污染气体生成,能体现绿色化学理念,答案选丙;
(4)要证明酸性强弱,应该采用强酸制取弱酸的方法检验,盐酸酸性最强,所以a中盛放盐酸,盐酸和碳酸钙或碳酸钠反应制取二氧化碳,二氧化碳和硅酸钠溶液反应生成硅酸沉淀,则c中盛放碳酸钙或碳酸钠、d中盛放硅酸钠,硅酸难溶于水,所以二氧化碳和硅酸钠反应生成硅酸沉淀,看到的现象是c中有气泡产生,d中生成白色胶状物质。


科目:高中化学 来源: 题型:
【题目】能源问题是人类社会面临的重大课题,甲醇是未来重要的能源物质之一。一定条件下,恒容密闭容器中,发生反应:CO(g)+2H2(g) ![]() CH3OH(g) 。下列能充分说明该反应已经达到化学平衡状态的是
CH3OH(g) 。下列能充分说明该反应已经达到化学平衡状态的是
A. 正、逆反应速率都等于零 B. CO、H2、CH3OH的浓度不再变化
C. CO、H2、CH3OH的浓度相等 D. CO、H2、CH3OH在密闭容器中共存
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池是将化学能转变为电能的装置。关于下图所示原电池的说法不正确的是
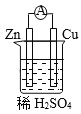
A. Cu为正极,Zn为负极 B. 电子由铜片通过导线流向锌片
C. 正极反应式为2H+ + 2e- ![]() H2↑ D. 原电池的反应本质是氧化还原反应
H2↑ D. 原电池的反应本质是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在100mL HNO3和H2SO4的混合溶液中,两种酸的物质的量浓度之和为0.6mol/L。向该溶液中加入足量的铜粉,加热,充分反应后,所得溶液中Cu2+的物质的量浓度最大值为(反应前后溶液体积变化忽略不计)
A. 0.225mol/L B. 0.30mol/L C. 0.36mol/L D. 0.45mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(10分)A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去)。
![]()
(1)若A是一种活泼金属,C是淡黄色固体,试用化学方程式表示该物质C的一个重要应用 ;
(2)若A是一种黄色单质固体,则B→C的化学方程式为 ;
(3)若A是一种黑色非金属单质固体,写出B的一个用途 ;
(4)若C是红棕色气体,则A化学式可能为 ,试写出C与水反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把7.2g铁粉投入40ml某HNO3溶液中,充分反应后剩余固体1.6g,产生NO2和NO的混合气体0.08mol,若不考虑N2O4的存在,则原HNO3溶液的物质的量浓度( )
A.3.5 mol/L
B.4.5 mol/L
C.7.0 mol/L
D.9.0 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮和碳的化合物与人类生产、生活密切相关。
(1)已知:N2(g)+O2(g)===2NO(g); ΔH=+180.5 kJ·mol-1
2H2(g)+O2(g)===2H2O(g); ΔH=-483.6 kJ·mol-1
则反应2H2(g)+2NO(g)===2H2O(g)+N2(g);ΔH=__________。
(2)在压强为0.1 MPa条件,将CO和H2的混合气体在催化剂作用下转化为甲醇的反应为CO(g)+2H2(g) ![]() CH3OH(g) ΔH<0
CH3OH(g) ΔH<0
①下列能说明该反应达到平衡状态的是________________。
a.混合气体的密度不再变化 b.CO和H2的物质的量之比不再变化
c.v(CO)=v(CH3OH) d.CO在混合气中的质量分数保持不变
②T1℃时,在一个体积为5 L的恒压容器中充入1 mol CO、2 mol H2,经过5 min达到平衡,CO的转化率为0.75,则T1℃时,CO(g)+2H2(g) ![]() CH3OH(g)的平衡常数K=_______________________。
CH3OH(g)的平衡常数K=_______________________。

③在T1℃时,在体积为5 L的恒容容器中充入一定量的H2和CO,反应达到平衡时CH3OH的体积分数与n(H2)/n(CO)的关系如图所示。温度不变,当![]() 时,达到平衡状态,CH3OH的体积分数可能是图象中的___________点。
时,达到平衡状态,CH3OH的体积分数可能是图象中的___________点。
(3)用催化转化装置净化汽车尾气,装置中涉及的反应之一为:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)

①探究上述反应中NO的平衡转化率与压强、温度的关系,得到如图1所示的曲线。催化装置比较适合的温度和压强是___________。
②测试某型号汽车在冷启动(冷启动指发动机水温低的情况下启动)时催化装置内CO和NO百分含量随时间变化曲线如图2所示。则前10 s内,CO和NO百分含量没明显变化的原因是____________。

(4)如图所示的装置能吸收和转化NO2和SO2。
①阳极区的电极反应式为___________________________。
②阴极排出的溶液中含S2O![]() 离子,能将NO2气体转化为无污染气体,同时生成的SO
离子,能将NO2气体转化为无污染气体,同时生成的SO![]() 可在阴极区再生。写出该反应的离子方程式:___________________________。
可在阴极区再生。写出该反应的离子方程式:___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型NaBH4/H2O2燃料电池(DBFC)的结构如图所示,(已知硼氢化钠中氢为﹣1价),有关该电池的说法正确的是( ) 
A.电极B材料中含MnO2层,MnO2可增强导电性
B.电池负极区的电极反应:BH4﹣+8OH﹣﹣8e﹣═BO2﹣+6H2O
C.放电过程中,Na+从正极区向负极区迁移
D.在电池反应中,每消耗1L 6mol/L H2O2溶液,理论上流过电路中的电子为6NA个
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com