
【题目】中国科学院科研团队研究表明,在常温常压和可见光下,基于![]() (一种固体催化剂)合成
(一种固体催化剂)合成![]() 的原理示意图如下。试回答下列问题:
的原理示意图如下。试回答下列问题:
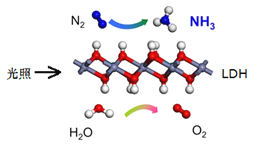
(1)从能量转换的角度,该过程将______转化成为__________;
(2)该反应的化学方程式为:________________,氧化剂与还原剂的物质的量之比为__________;
(3)关于该反应的说法,正确的是_______
A.催化剂能增大化学反应速率,缩短反应时间,从而提高产氨效率
B.该反应过程中涉及极性键和非极性键的断裂和形成
C.可以通过分离液态空气的方法获得氮气
D.基于![]() 合成
合成![]() 的过程属于人工固氮
的过程属于人工固氮
(4)现代工业常以氯化钠、二氧化碳和氨气为原料制备纯碱。加入原料的顺序是:在氯化钠溶液,通入_________至饱和,再通入足量的_________可制得![]() 。
。
【答案】太阳能/光能 化学能 
![]() ABCD
ABCD ![]()
![]()
【解析】
根据图示,该反应为N2和H2O在常温常压和可见光、LDH存在下反应生成NH3和O2。
(1)反应过程中通过光照进行反应,故从能量转换的角度,该过程将光能转化为化学能;
(2)根据图示,该反应的化学方程式为2N2+6H2O 4NH3+3O2;反应中N2得到电子做氧化剂,H2O中O原子失去电子做还原剂,故氧化剂与还原剂的物质的量比为2:6=1:3;
4NH3+3O2;反应中N2得到电子做氧化剂,H2O中O原子失去电子做还原剂,故氧化剂与还原剂的物质的量比为2:6=1:3;
(3)A.加入适当的催化剂,可以降低化学反应活化能,加快反应速率,从而提高合成氨的效率,A正确;
B.反应过程中N2中N≡N键、H2O中H-O键发生断裂,NH3中N-H键、O2中O=O键生成,其中N≡N键和O=O键为非极性共价键,H-O键和N-H键为极性共价键,因此反应过程中涉及极性键和非极性键的断裂和形成,B正确;
C.空气中含有大量的N2,可以通过分离液态空气的方法得到N2,C正确;
D.题目中所示的方法属于人工固氮的方法,D正确;
故答案为ABCD。
(4)现代工业常以氯化钠、二氧化碳和氨气为原料制备纯碱。加入原料的顺序是:在氯化钠溶液,通入NH3至饱和,再通入足量的CO2可制得NaHCO3,原因是:NH3在溶液中的溶解度较大,先通入NH3后,可以吸收更多的CO2生成高浓度的HCO3-,从而提高纯碱的产率。


科目:高中化学 来源: 题型:
【题目】随着科学技术的发展和环保要求的不断提高,CO2的捕集利用技术成为研究的重点。完成下列填空:
(1)目前国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的反应方程式为:CO2(g)+4H2(g)![]() CH4(g)+2H2O(g),已知H2的体积分数随温度的升高而增加.若温度从300℃升至400℃,重新达到平衡,判断下列表格中各物理量的变化。(选填“增大”、“减小”或“不变”)
CH4(g)+2H2O(g),已知H2的体积分数随温度的升高而增加.若温度从300℃升至400℃,重新达到平衡,判断下列表格中各物理量的变化。(选填“增大”、“减小”或“不变”)
v正 | v逆 | 平衡常数K | 转化率α |
________ | ________ | ________ | ________ |
(2)相同温度时,上述反应在不同起始浓度下分别达到平衡,各物质的平衡浓度如下表:
[CO2]/molL﹣1 | [H2]/molL﹣1 | [CH4]/molL﹣1 | [H2O]/molL﹣1 | |
平衡Ⅰ | a | b | c | d |
平衡Ⅱ | m | n | x | y |
a、b、c、d与m、n、x、y之间的关系式为________.
(3)碳酸:H2CO3 , K1=4.3×10﹣7 , K2=5.6×10﹣11 草酸:H2C2O4 , K1=5.9×10﹣2 , K2=6.4×10﹣5 ,0.1mol/LNa2CO3溶液的pH____0.1mol/LNa2C2O4溶液的pH,(选填“大于”“小于”或“等于”),等浓度的草酸溶液和碳酸溶液中,氢离子浓度较大的是___.
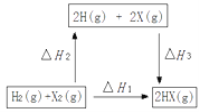
(4)在如图的转化关系中(X代表卤素)。ΔH2_____0(填“>”、“=”或“<”);△H1、△H2和△H3三者存在的关系为_______。
(5)现有浓度均为0.1mol·L-1的下列溶液:①硫酸、②醋酸、③氢氧化钠、④醋酸钠。请回答下列问题:
①醋酸钠中各离子浓度由大到小的顺序是_______。
②醋酸和醋酸钠等体积混合所得溶液中:c(CH3COOH)+c(CH3COO-)=______mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)写出下列物质的电子式:Na2O2_____NH3_____。
(2)2.2g铵根14N2H4+的中子数是___,核外电子数是____,某微粒含有一个原子核,核中有 17个质子,20个中子,核外有 18个电子,该粒子的化学符号是____。
(3)已知断开 1mol H—H 键、1mol I—I 键、1mol H—I 键分别需要吸收的能量为 436kJ、151kJ、299kJ,则由 1mol H2和 1mol I2生成 2mol HI会_____(“放出”或“吸收”)_____kJ 的热量。
(4)现有下列物质:①H2 ②Na2O2 ③NaOH ④H2O2 ⑤CaCl2 ⑥NH4NO3 ⑦H2S,只由离子键构成的物质是_____(填序号,同下),由离子键和共价键构成的物质是_________,属于共价化合物的是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为CaF2、H3BO3(层状结构,层内的H3BO3分子通过氢键结合)、金属铜三种晶体的结构示意图,请回答下列问题:

(1)图Ⅰ所示的CaF2晶体中与Ca2+最近且等距离的F-数为_______,图Ⅲ中未标号的铜原子形成晶体后周围最紧邻的铜原子数为_______。
(2)三种晶体中熔点最低的是________,其晶体受热熔化时,克服的微粒之间的相互作用为________。
(3)结合CaF2晶体的晶胞示意图,已知,两个距离最近的Ca2+核间距离为a×10-8 cm,计算CaF2晶体的密度为________g·cm-3(精确到小数点后一位数,NA用具体数字代进去计算)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将不同量的CO(g)和H2O(g)分别通入体积为2 L的恒容密闭容器中,进行反应CO(g)+H2O(g)![]() CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | H2 | CO | |||
1 | 650 | 2 | 4 | 1.6 | 2.4 | 6 |
2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
①实验1中从反应开始至平衡以CO2表示的平均反应速率为v(CO2)=____(取小数点后两位,下同)。
②该反应的正反应为___(填“吸”或“放”)热反应,实验2条件下平衡常数K=___。
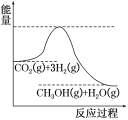
(2)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,达到平衡后下列措施中能使c(CH3OH)增大的是____。
CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,达到平衡后下列措施中能使c(CH3OH)增大的是____。
a.升高温度 b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来 d.再充入1 mol CO2和3 mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列实验探究亚硝酸钠(NaNO2)的化学性质。(AgNO2是淡黄色难溶于水的固体)
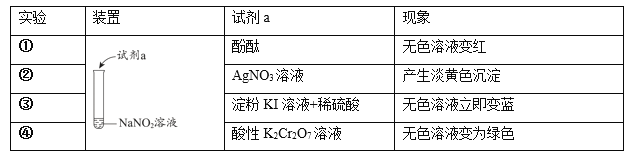
由上述实验所得结论不正确的是
A.NaNO2溶液呈碱性:NO2- +H2O![]() HNO2 +OH-
HNO2 +OH-
B.NaNO2可与某些盐发生复分解反应:NO2- + Ag+= AgNO2↓
C.NaNO2有氧化性:2I- + 2H+ + 2NO2-= I2 + 2NO2↑ + H2O
D.NaNO2有还原性:Cr2O72- + 3NO2-+ 8H+=3NO3- + 2Cr3+ + 4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】北京市场销售的某种食用精制盐包装袋上有如下说明:
产品标准 | GB5461 |
产品等级 | 一级 |
配 料 | 食盐、碘酸钾、抗结剂 |
碘含量(以I计) | 20~50mg/kg |
分装时期 | |
分装企业 |
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处)
____KIO3+___KI+___H2SO4=___K2SO4+___I2+___H2O
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
①Na2SO3稀溶液与I2反应的离子方程式是_________________________________。
②某学生设计回收四氯化碳的操作步骤为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体。
以上设计中遗漏的操作及在上述步骤中的位置是______________________。
(3)已知:I2+2S2O32-=2I-+S4O62-。某学生测定食用精制盐的碘含量,其步骤为:
a. 准确称取wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液10.0mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是______________________。
②b中反应所产生的I2的物质的量是___________mol。
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)
_______________________mg/kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe、Co、Ni均为第Ⅷ族元素,它们的化合物在生产、生活中有着广泛的应用。
(1)基态Co原子的价电子排布式为________,Co2+核外3d能级上有________对成对电子。
(2)Co3+的一种配离子[Co(N3)(NH3)5]2+中,Co3+的配位数是________。1 mol配离子中所含σ键的数目为____________,配位体N3-中心原子的杂化类型为____________。
(3)Co2+在水溶液中以[Co(H2O)6]2+存在。向含Co2+的溶液中加入过量氨水可生成更稳定的[Co(NH3)6]2+,其原因是__________________________。
(4)某蓝色晶体中,Fe2+、Fe3+分别占据立方体互不相邻的顶点,而立方体的每条棱上均有一个CN-,K+位于立方体的某恰当位置上。据此可知该晶体的化学式为________,立方体中Fe2+间连接起来形成的空间构型是________。
(5)NiO的晶胞结构如图甲所示,其中原子坐标参数A为(0,0,0),B为(1,1,0),则C原子坐标参数为________。
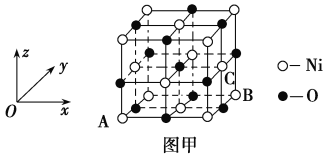
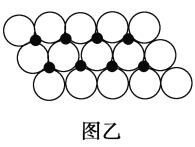
(6)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-为密置单层排列,Ni2+填充其中(如图乙),已知O2-的半径为a pm,每平方米面积上分散的该晶体的质量为_____g(用含a、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,某反应达到平衡,平衡常数K=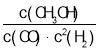 。恒容时,温度升高,H2浓度增大。下列说法正确的是( )
。恒容时,温度升高,H2浓度增大。下列说法正确的是( )
A. 该反应的化学方程式为CH3OH![]() CO+2H2
CO+2H2
B. 使用催化剂,H2浓度一定减小
C. 升高温度,逆反应速率减小
D. 该反应的焓变(ΔH)为负值
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com