
【题目】一定温度下,某反应达到平衡,平衡常数K=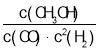 。恒容时,温度升高,H2浓度增大。下列说法正确的是( )
。恒容时,温度升高,H2浓度增大。下列说法正确的是( )
A. 该反应的化学方程式为CH3OH![]() CO+2H2
CO+2H2
B. 使用催化剂,H2浓度一定减小
C. 升高温度,逆反应速率减小
D. 该反应的焓变(ΔH)为负值
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】中国科学院科研团队研究表明,在常温常压和可见光下,基于![]() (一种固体催化剂)合成
(一种固体催化剂)合成![]() 的原理示意图如下。试回答下列问题:
的原理示意图如下。试回答下列问题:
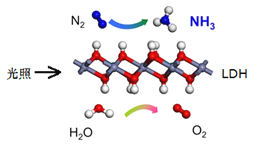
(1)从能量转换的角度,该过程将______转化成为__________;
(2)该反应的化学方程式为:________________,氧化剂与还原剂的物质的量之比为__________;
(3)关于该反应的说法,正确的是_______
A.催化剂能增大化学反应速率,缩短反应时间,从而提高产氨效率
B.该反应过程中涉及极性键和非极性键的断裂和形成
C.可以通过分离液态空气的方法获得氮气
D.基于![]() 合成
合成![]() 的过程属于人工固氮
的过程属于人工固氮
(4)现代工业常以氯化钠、二氧化碳和氨气为原料制备纯碱。加入原料的顺序是:在氯化钠溶液,通入_________至饱和,再通入足量的_________可制得![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对图像的叙述正确的是
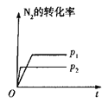
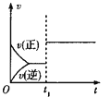
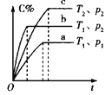

甲 乙 丙 丁
A.图甲可表示压强对反应:![]()
![]() 的影响
的影响
B.图乙中,![]() 时刻改变的条件一定是加入了催化剂
时刻改变的条件一定是加入了催化剂
C.若图丙表示反应:![]() ,则
,则![]() 、
、![]()
D.图丁表示水中![]() 和
和![]() 的关系,ABC所在区域总有
的关系,ABC所在区域总有![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:![]() +CH3CHO+HBr
+CH3CHO+HBr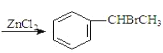 +H2O(卤烷基化反应);
+H2O(卤烷基化反应);
![]() +
+![]()
![]()
![]() +NaX
+NaX
用苯为原料合成化合物Ⅳ的线路如下:
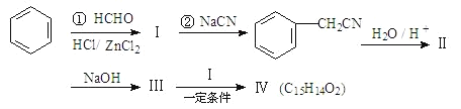
其中:Ⅱ是羧酸。请回答下列问题:
(1)②的反应类型是________。
(2)写出同时符合下列条件的化合物Ⅱ的同分异构体结构简式(写2种)_____、_____。
a.能与FeCl3溶液作用显紫色;
b.能发生银镜反应;
c.核磁共振氢谱除苯环峰外还有三组峰,峰面积之比为为 1:2:1。
(3)1mol化合物Ⅳ完全燃烧消耗O2_____mol,化合物Ⅳ的结构简式是__________。
(4)化合物Ⅱ与乙醇、浓硫酸共热,合成一种香精原料,试写出该反应的化学方程式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A. 碳酸的电离:H2CO3![]() H+ +HCO3-
H+ +HCO3-
B. 将金属钠放入水中:Na+2H2O = Na+ +2OH-+H2↑
C. 碳酸钠水解:CO32-+2H2O = H2CO3+2OH-
D. 向氯化铝溶液中加入过量的烧碱溶液:Al3+ +3OH-= Al(OH)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O5是一种新型硝化剂,其性质和制备受到人们的关注。已知N2O5能与水发生反应,并放出大量的热。
Ⅰ.一定温度下,在恒容密闭容器中N2O5发生下列反应:2N2O5(g)![]() 4NO2(g)+O2(g)ΔH。
4NO2(g)+O2(g)ΔH。
(1)下表为反应在T1温度下的部分实验数据:
t/s | 0 | 500 | 1000 |
c(N2O5)/mol·L—1 | 5.00 | 3.52 | 2.48 |
则500s内NO2的生成速率为______________。
(2)反应达到平衡后,若再通入一定量N2O5,达到新平衡时,N2O5的转化率将______(填“增大”、“减小”、“不变”)。
(3)在温度T1和T2时,N2O5的浓度与反应时间的关系如图所示。据此判断:T1______T2(填“>”、“<”或“=”,下同),ΔH______0。
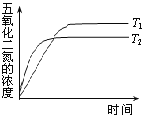
Ⅱ.下图所示装置,可用于制备N2O5气体。A是电源的____________(填“负极”或“正极”),电解池的阳极反应式为______________________________________________________。
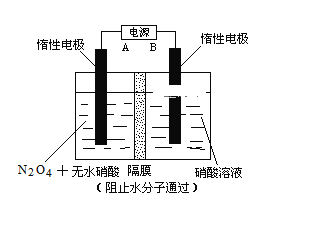
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究减少CO2排放是一项重要课题。CO2经催化加氢可以生成低碳有机物,主要有以下反应:
反应Ⅰ:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H1=-49.6 kJ/mol
CH3OH(g)+H2O(g) △H1=-49.6 kJ/mol
反应Ⅱ:CH3OCH3(g)+H2O(g) ![]() 2CH3OH(g) △H2=+23.4 kJ/mol
2CH3OH(g) △H2=+23.4 kJ/mol
反应Ⅲ:2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g) △H3
CH3OCH3(g)+3H2O(g) △H3
(1)△H3=________kJ/mol。
(2)恒温恒容条件下,在密闭容器中通入等物质的量的CO2和H2,发生反应I。下列描述能说明反应I达到平衡状态的是_______(填序号)。
A.反应体系总压强保持不变
B.容器内的混合气体的密度保持不变
C.水分子中断裂2NA个H-O键,同时氢分子中断裂3NA个H-H键
D.CH3OH和H2O的浓度之比保持不变
(3)反应II在某温度下的平衡常数为0.25,此温度下,在密闭容器中加入等物质的量的CH3OCH3(g)和H2O(g),反应到某时刻测得各组分浓度如下:
物质 | CH3OCH3(g) | H2O(g) | CH3OH(g) |
浓度/mol·L-1 | 1.8 | 1.8 | 0.4 |
此时v正___v逆(填“>”、“<”或“=”),当反应达到平衡状态时,混合气体中CH3OH体积分数(CH3OH)% =___%。
(4)在某压强下,反应III在不同温度、不同投料比时,CO2的平衡转化率如图所示。T1温度下,将6mol CO2和12mol H2充入2 L的密闭容器中,5min后反应达到平衡状态,则0~5min内的平均反应速率v(CH3OCH3)=____;KA、KB、KC三者之间的大小关系为____。
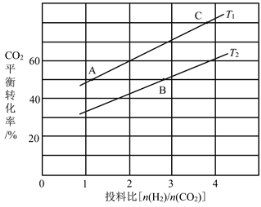
(5)恒压下将CO2和H2按体积比1:3混合,在不同催化剂作用下发生反应I和反应III,在相同的时间段内CH3OH的选择性和产率随温度的变化如图。其中:CH3OH的选择性=![]() ×100%
×100%

在上述条件下合成甲醇的工业条件是____。
A.210℃ B.230℃ C.催化剂CZT D.催化剂CZ(Zr-1)T
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素的一个原子形成的离子可表示为![]() n-,下列说法正确的是( )
n-,下列说法正确的是( )
A.![]() n-中含有的中子数为a+b
n-中含有的中子数为a+b
B.![]() n-中含有的电子数为a-n
n-中含有的电子数为a-n
C.X原子的质量数为a+b+n
D.一个X原子的质量约为![]() g
g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某白色粉状固体X,它是碘的一种较稳定氧化物,M=334 g·mol-1;有关化学性质与转化如下:
①X在343K时,与CO作用生成B和CO2;
②X在573K时,分解生成A和B;
③X与水作用生成D;
④D+HCl→B+Z+H2O;
⑤Z与氯仿在一定条件下生成灭火剂Y等。
又知A、B、Z是常见单质。试分析并回答:
(1)组成B的元素处于第_____________族。
(2)写出②的化学方程式:_______________。
(3)写出Y的分子式:_________
(4)B与KI作用生成的阴离子的符号是_________
(5)写出④的离子方程式:____________。
(6)根据较为完全的反应①,再利用某一经典反应原理(方法),在工业上可以测定废气中CO的含量。试简述其测定方法:________。
(7)Z与氯仿反应的方程式一般为Z+氯仿→Y+氢化物,但也有另一种可能,其化学方程式是______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com