
【题目】N2O5是一种新型硝化剂,其性质和制备受到人们的关注。已知N2O5能与水发生反应,并放出大量的热。
Ⅰ.一定温度下,在恒容密闭容器中N2O5发生下列反应:2N2O5(g)![]() 4NO2(g)+O2(g)ΔH。
4NO2(g)+O2(g)ΔH。
(1)下表为反应在T1温度下的部分实验数据:
t/s | 0 | 500 | 1000 |
c(N2O5)/mol·L—1 | 5.00 | 3.52 | 2.48 |
则500s内NO2的生成速率为______________。
(2)反应达到平衡后,若再通入一定量N2O5,达到新平衡时,N2O5的转化率将______(填“增大”、“减小”、“不变”)。
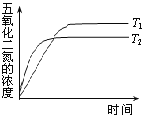
(3)在温度T1和T2时,N2O5的浓度与反应时间的关系如图所示。据此判断:T1______T2(填“>”、“<”或“=”,下同),ΔH______0。
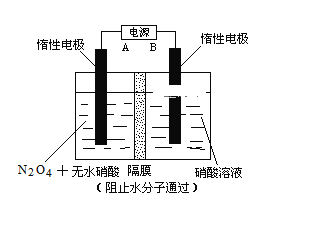
Ⅱ.下图所示装置,可用于制备N2O5气体。A是电源的____________(填“负极”或“正极”),电解池的阳极反应式为______________________________________________________。
【答案】0.00592mol·L-1·s-1 减小 < > 正极 N2O4+2HNO3-2e-=2N2O5+2H+
【解析】
Ⅰ.(1)根据实验数据,结合化学反应速率的定义式![]() 及计算方法求解;
及计算方法求解;
(2)再加入N2O5,相当于加压,结合压强对平衡的影响效果分析;
(3)结合图像,依据 “先拐先平数值大”的规律分析作答;
Ⅱ.阳极发生失电子的氧化反应,N2O4转化为N2O5,化合价升高,据此判断电源的正负极;再依据电解池原理书写电极反应式。
Ⅰ.(1)参加反应的各物质表示的化学反应时速率之比等于化学计量数之比,则500s内NO2的生成速率![]() =0.00592 mol·L-1·s-1;
=0.00592 mol·L-1·s-1;
(2)平衡后再加入一定量的N2O5,增大了体系的压强,会使反应2N2O5(g)![]() 4NO2(g)+O2(g)的平衡向逆反应方向移动,则N2O5的转化率减小;
4NO2(g)+O2(g)的平衡向逆反应方向移动,则N2O5的转化率减小;
(3)从图像中可以看出,反应在T2温度下先达到平衡,则说明在T2温度下反应速率更快,即T1<T2;温度升高,N2O5的浓度降低,则说明升高温度,平衡向正反应方向移动,该反应为吸热反应,ΔH>0,故答案为:<;>;
Ⅱ.制备N2O5气体的电解池装置中,左侧N2O4转化为N2O5,化合价升高,失电子发生氧化反应,则左侧惰性电极为阳极,连接电源的正极,其电极反应式为:N2O4+2HNO3-2e-=2N2O5+2H+,故答案为:正极;N2O4+2HNO3-2e-=2N2O5+2H+。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】利用下列实验探究亚硝酸钠(NaNO2)的化学性质。(AgNO2是淡黄色难溶于水的固体)
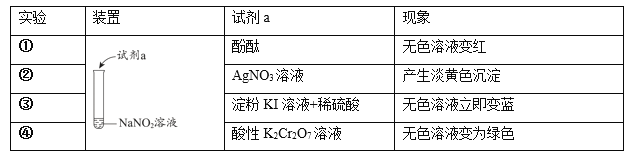
由上述实验所得结论不正确的是
A.NaNO2溶液呈碱性:NO2- +H2O![]() HNO2 +OH-
HNO2 +OH-
B.NaNO2可与某些盐发生复分解反应:NO2- + Ag+= AgNO2↓
C.NaNO2有氧化性:2I- + 2H+ + 2NO2-= I2 + 2NO2↑ + H2O
D.NaNO2有还原性:Cr2O72- + 3NO2-+ 8H+=3NO3- + 2Cr3+ + 4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金银花有效活性成分为绿原酸,又名咖啡鞣酸,具有广泛的杀菌消炎功效,结构如图所示,下列有关绿原酸的说法正确的是( )
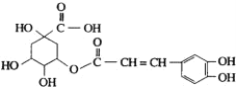
A. 绿原酸的分子式为C16H8O9
B. 1mol 绿原酸最多与7molNaOH反应
C. 1个绿原酸分子最多与4mol氢气反应
D. 绿原酸分子中有4种化学环境不同的氢原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式及有关应用的叙述中,正确的是
A. 甲烷的燃烧热为890.3kJmol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+ 2O2(g) ═ CO2(g) + 2H2O(g) △H = -890.3kJmol-1
B. 已知强酸与强碱在稀溶液里反应的中和热为57.3kJmol-1,则![]() H2SO4(aq)+
H2SO4(aq)+![]() Ba(OH)2(aq)═
Ba(OH)2(aq)═![]() BaSO4(s)+H2O(l) △H < -57.3kJmol-1
BaSO4(s)+H2O(l) △H < -57.3kJmol-1
C. 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g) + 3H2(g)![]() 2NH3(g) △H = -38.6kJmol-1
2NH3(g) △H = -38.6kJmol-1
D. 已知25℃、101KPa条件下:4Al(s) + 3O2(g) ═ 2A12O3(s) △H = -2834.9kJmol-1,4Al(s) + 2O3(g) ═ 2A12O3(s) △H = -3119.1kJmol-1,则O3比O2稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,某反应达到平衡,平衡常数K=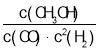 。恒容时,温度升高,H2浓度增大。下列说法正确的是( )
。恒容时,温度升高,H2浓度增大。下列说法正确的是( )
A. 该反应的化学方程式为CH3OH![]() CO+2H2
CO+2H2
B. 使用催化剂,H2浓度一定减小
C. 升高温度,逆反应速率减小
D. 该反应的焓变(ΔH)为负值
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2的催化氧化是工业制取硫酸的关键步骤之一,该反应的化学方程式为:2SO2+O2![]() 2SO3,
2SO3,
△H<0。请回答下列问题:
(1)判断该反应达到平衡状态的标志是__________(填字母)。
a.SO2和SO3浓度相等 b.SO2百分含量保持不变
c.容器中气体的压强不变 d.SO3的生成速率与SO2的消耗速率相等
(2)当该反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高SO2平衡转化率的
是______________(填字母)。
a.向装置中再充入N2 b.向装置中再充入O2
c.改变反应的催化剂 d.降低温度
(3)将0.050 mol SO2 (g)和0.030 mol O2 (g)放入容积为1L的密闭容器中,在一定条件下达到平衡,测得c(SO3) =0.040mol/L。计算该条件下反应的平衡常数K和SO2的转化率(不必写出计算过程)。
①平衡常数K=______________;
②平衡时,SO2的转化率α (SO2) =_____________。
(4)SO2尾气常用饱和Na2SO3溶液吸收,减少SO2气体污染并可得到重要的化工原料NaHSO3。己知NaHSO3溶液同时存在以下两种平衡:①HSO3-![]() SO32-+H+ ②HSO3-+H2O
SO32-+H+ ②HSO3-+H2O![]() H2SO3+OH-、常温下,0.1 mol/LNaHSO3溶液的 pH<7,则该溶液中 c (H2SO3)__________c (SO32-)(填“>”或“=”或“<”下同)。
H2SO3+OH-、常温下,0.1 mol/LNaHSO3溶液的 pH<7,则该溶液中 c (H2SO3)__________c (SO32-)(填“>”或“=”或“<”下同)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸碱中和滴定是中学化学常见实验。
Ⅰ.下图表示50mL酸式滴定管中液面的位置,如果液面处的读数是a,则滴定管中剩余液体的体积是______mL。
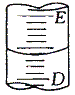
A、a B、大于a C、小于(50-a) D、大于(50-a)
Ⅱ.某同学欲测定某浓硫酸样品的物质的量浓度,进行了以下实验操作:
A 冷却至室温后,在100mL容量瓶中定容配成100mL稀硫酸。
B 量取20.00mL稀硫酸于锥形瓶中并滴入几滴指示剂。
C 将酸式滴定管和碱式滴定管用蒸馏水洗涤干净,并用各待盛溶液润洗。
D 将物质的量浓度为1.50 mol·L-1的标准NaOH溶液装入碱式滴定管,调节液面记下读数V1。
E 继续滴定至终点,记下读数为V2。
F 在锥形瓶下垫一张白纸,把锥形瓶移到碱式滴定管下小心滴入NaOH标准溶液,边滴边摇动锥形瓶。
G 量取浓硫酸样品5 mL,在烧杯中用蒸馏水溶解。
H 重复以上实验。
请回答下列问题:
(1)该实验正确操作步骤的顺序为____→ A →_____→_____→D→_____→_____→ H(用编号字母填写)。
(2)量取5mL浓硫酸的仪器是________________________;量取20.00mL稀硫酸的仪器是_________。
(3)选用的指示剂是_____________。滴定过程中,视线应注视____________________;判断到达滴定终点的现象是________________;读数时,视线应____________(填“高于”、“低于”或“相平于”)溶液凹液面的最低处。
(4)下表是实验测得的有关数据:
滴定序号 | 待测稀硫酸的体积(mL) | 所消耗NaOH标准溶液液的体积(mL) | |
V1 | V2 | ||
① | 20.00 | 0.50 | 22.60 |
② | 20.00 | 6.00 | 27.90 |
请计算出该浓硫酸样品的浓度为____________mol·L-1 (不必写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机化合物对应类别的同分异构体数目最少的是(不考虑立体异构)
选项 | A | B | C | D |
分子式 | C9H12 | C5H12O | C4H8O2 | C4H8FCl |
类别 | 芳香烃 | 醇 | 酯 | 卤代烃 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年发生的天津港有关仓库物品爆炸涉及电石与氰化钠等,而CN-作为配位剂可形成[Au(CN)2]-、[Ag(CN)2]-、[Zn(CN)4]2-、[Fe(CN)3]4-、[Fe(CN)4]3-等。常把原子个数相同,最外层电子数也相同的微粒称作等电子体,同时它们的结构相似。
试分析并回答:
(1)电石的主要成分是__________(写化学式),其中阴离子与CN-是等电子体,写出CN-的电子式:__________。
(2)有着“闪电式死亡”之称的剧毒物品氰化钠,在地面水中很不稳定,pH大于7时,可被氧气氧化成碳酸盐和氨气,试写出该反应的离子方程式:______。
(3)以剧毒物氰化钠比例,从反应原理角度去思考如何防止其污染。试提出两个有关应用的好方案________、_______。
(4)电石中还含有CaS等,与水反应还有H2S的生成,H2S完全氧化生成S2,S2又可催化氧化生成SO3。已知2SO2(g)+O2(g)![]() 2SO3(g) △H<0。某温度下,将2mol SO2和1 mol O2置于10L密闭容器中,反应达到平衡后,SO2的平衡转化率(a)与体系总压强(p)的关系如图所示。
2SO3(g) △H<0。某温度下,将2mol SO2和1 mol O2置于10L密闭容器中,反应达到平衡后,SO2的平衡转化率(a)与体系总压强(p)的关系如图所示。
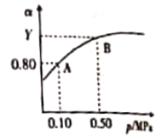
则①Y大于0.8的原因是__________;
②K(A)____________(填“大于”“等于”或“小于”)K(B);
③若压强为0.10MPa,试做出T1、T2不同温度下(设T2< T1)SO2转化率与温度的关系图__________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com