
����Ŀ��SO2�Ĵ������ǹ�ҵ��ȡ����Ĺؼ�����֮һ���÷�Ӧ�Ļ�ѧ����ʽΪ��2SO2+O2![]() 2SO3��
2SO3��
��H<0����ش��������⣺
��1���жϸ÷�Ӧ�ﵽƽ��״̬�ı�־��__________(����ĸ����
a.SO2��SO3Ũ����� b.SO2�ٷֺ������ֲ���
c.�����������ѹǿ���� d.SO3������������SO2�������������
��2�����÷�Ӧ����ƽ��״̬ʱ�����������������£����д�ʩ�����������SO2ƽ��ת���ʵ�
��______________(����ĸ)��
a.��װ�����ٳ���N2 b.��װ�����ٳ���O2
c.�ı䷴Ӧ�Ĵ��� d.�����¶�
��3����0.050 mol SO2 (g)��0.030 mol O2 (g)�����ݻ�Ϊ1L���ܱ������У���һ�������´ﵽƽ�⣬���c(SO3) =0.040mol/L������������·�Ӧ��ƽ�ⳣ��K��SO2��ת����(����д���������)��
��ƽ�ⳣ��K=______________��
��ƽ��ʱ��SO2��ת������ (SO2) =_____________��
��4��SO2β�����ñ���Na2SO3��Һ���գ�����SO2������Ⱦ���ɵõ���Ҫ�Ļ���ԭ��NaHSO3����֪NaHSO3��Һͬʱ������������ƽ�⣺��HSO3-![]() SO32-+H+ ��HSO3-+H2O
SO32-+H+ ��HSO3-+H2O![]() H2SO3+OH-�������£�0.1 mol/LNaHSO3��Һ�� pH<7�������Һ�� c (H2SO3)__________c (SO32-)(����>������=������<����ͬ����
H2SO3+OH-�������£�0.1 mol/LNaHSO3��Һ�� pH<7�������Һ�� c (H2SO3)__________c (SO32-)(����>������=������<����ͬ����
���𰸡� bc bd 1.6��103 80% <
���������������������1��a��SO2��SO3Ũ����ȣ�����˵�����淴Ӧ������ͬ������˵����Ӧ�ﵽƽ��״̬��a����b��SO2�ٷֺ������ֲ�����ƽ���־��b��ȷ��c����Ӧǰ��������������仯�������������ѹǿ����˵����Ӧ�ﵽƽ��״̬��c��ȷ��d��SO3������������SO2����������������淴Ӧ������У�����˵����Ӧ�ﵽƽ��״̬��d����ѡbc��
��2�����÷�Ӧ����ƽ��״̬ʱ�����������������£����SO2ƽ��ת���ʣ�ƽ��������У�a����װ�����ٳ���N2�����ݺ�����������ѹ�����ѹ���䣬ƽ�ⲻ�䣬a����b�����ַ�Ӧ������һ�ֻ������һ�ֵ�ת���ʣ���װ�����ٳ���O2������߶�������ת���ʣ�b��ȷ��c���ı䷴Ӧ�Ĵ������ı䷴Ӧ���ʲ��ı仯ѧƽ�⣬c����d����Ӧ�Ƿ��ȷ�Ӧ�������¶�ƽ��������У���������ת��������d��ȷ����ѡbd��
��3�� 2SO2+O2![]() 2SO3��
2SO3��
��ʼŨ�ȣ�mol/L�� 0.05 0.03 0
�仯Ũ�ȣ�mol/L�� 0.04 0.02 0.04
ƽ��Ũ�ȣ�mol/L�� 0.01 0.01 0.04
��ƽ�ⳣ��K=![]() ��1.6��103
��1.6��103
��ƽ��ʱ��SO2��ת��������SO2��=![]() ��100%=80%��
��100%=80%��
��4����֪NaHSO3�е�HSO3-���ܵ�������ˮ�⣺HSO3-![]() H++SO32-���������ԣ�HSO3-+H2O
H++SO32-���������ԣ�HSO3-+H2O![]() H2SO3+OH-ˮ���Լ��ԣ������£�0.1molL-1NaHSO3��Һ��pHС��7��˵���������ˮ�⣬�ʣ�c��SO32-����c��H2SO3����
H2SO3+OH-ˮ���Լ��ԣ������£�0.1molL-1NaHSO3��Һ��pHС��7��˵���������ˮ�⣬�ʣ�c��SO32-����c��H2SO3����


 ���ٴ�����ɽ����ϵ�д�
���ٴ�����ɽ����ϵ�д� ���ٴ���������ѧϰ����ѧ�ں����ν�ϵ�д�
���ٴ���������ѧϰ����ѧ�ں����ν�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʹ����������չ���������ı�־֮һ���������ü��ֳ��ý������Ⱥ�˳������Ϊ��ͭ����������֮�������Ⱥ���Ҫȡ����( )
A. �����ڵؿ��еĺ������� B. �������۷е�ߵ�
C. �����Ļ�����ǿ�� D. �����ĵ�����ǿ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E�Ǻ˵����������5�ֶ�����Ԫ�أ�ԭ�Ӱ뾶��D��E��B��C��A�ݼ���B��Eͬ���壬�������ƶ���ȷ����( )
A. A��B��E-������������ͬ�Ķ�����
B. A��D��������ͬһ����
C. C������������Ӧ��ˮ��������Լ���
D. C��D�ĵ��ʲ����ܻ��ϳ�1��1�����ӻ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и߷��������У�����ˮ�����
A. ���� B. ��ά�� C. ������ D. ����ϩ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з����У�����ԭ�ӵ�������Ϊ8���ӽṹ���ǣ� ��
A.BeCl2
B.H2S
C.NCl3
D.PCl5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������е�һ����ԭ�ӱ���ȡ�������üװ���CH3NH2���������백���ƣ�CH3NH2��H2OҲ��һԪ���25��ʱ���볣��Kb=4.0��10-5������0.0500mol/L��ϡ����ζ�l0mL 0.1000mol/L�ļװ���Һ����Һ��c(OH-)�ĸ�������pOH��������ϡ����������V���Ĺ�ϵ��ͼ��ʾ������˵����ȷ����
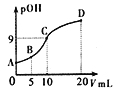
A. �װ���ˮ�еĵ��뷽��ʽΪ��CH3NH2��H2O=CH3NH3++OH-
B. A��B��C������Һ�У�ˮ���������c(H+):B>C>A
C. C��������Һ��![]()
D. B����Һ�д���c(CH3NH2��H2O)>c(CH3NH3+)>c(H+)>c(OH-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������þ�Ļ����Һ�У���μ���ϡ����������Һ��ֱ�����������б�ʾ�������Ƽ�������x������Һ�г���������y���Ĺ�ϵʾ��ͼ����ȷ���ǣ� ��
A��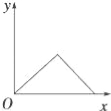 B��
B��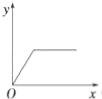 C��
C��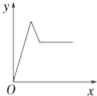 D��
D��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�� A��������Ԫ����ɵĻ����ij�о�С�鰴��ͼ����̽������ɣ�
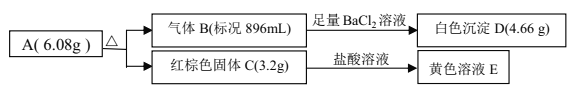
��ش�
��1��д������ɫ���� C �Ļ�ѧʽ____________��
��2��д�� A ���ȷֽⷴӦ�Ļ�ѧ����ʽ____________��
��3��д������ B ����Һ E ��Ӧ�����ӷ���ʽ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ѱۣ����ʯ���� TiO2�����㷺�����������ɫ���ᡣ��ҵ������������Ҫ�ɷ�Ϊ FeTiO3������ Fe2O3 �� SiO2 �����ʣ�Ϊԭ�����Ѱ۵���Ҫ�������£�
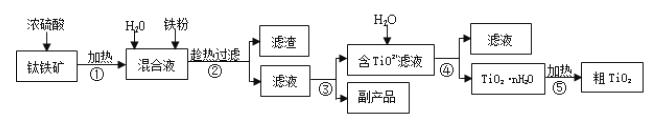
�ش��������⣺
��1���ڢڲ����������ijɷ���________��
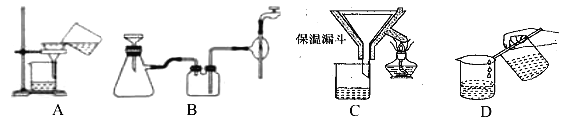
��2������������Ҫ�����������γ� TiO2��nH2O �ܽ����ù��չ�����Ҫ��ʵ��������ɣ����еġ����ˡ���������ѡ������װ��________����ѡ���
��3���ڢ۲���ʵ�������______�����ˣ��Ӷ���ø���Ʒ FeSO4��7H2O��
��4��Ϊ�ⶨ������������Һ��TiO2+��Ũ�ȣ�ȡ������Һ10 mL ������ˮϡ����100 mL������������ۣ������ʹ����ȫ��Ӧ��3TiO2+ + Al + 6H+ = 3Ti3+ + Al3+ + 3H2O�����˺�ȡ����Һ20.00 mL��������ʱ������Һ����ı仯���Բ��ƣ��������еμ�2��3 ��KSCN��Һ��ָʾ������ 0.1000 mol��L-1NH4Fe(SO4)2 ����Һ�ζ�����Һ���ֺ�ɫ����ʱ��Һ�� Ti3+ȫ��������Ϊ Ti4+�����ı�Һ30.00mL���ش��������⣺
�����в�����ʹ���� TiO2+Ũ��ƫ�ߵ���______��
A. �����Ʊ�Һ�Ĺ����У�δϴ���ձ��Ͳ�����
B. �����Ʊ�Һ�����Ǹ��ӿ̶���
C��������ˮϴ�Ӻ�δ����ϴ�ĵζ���ȡ����Һ
D���ڵζ��յ����ʱ���ӵζ��̶ܿ���
����ô�����Һ�� TiO2+�����ʵ���Ũ����______��
��5����ѧ�Ҵӵ��ұ�����Ĺ����еõ��������ҳ���ұ���ѵ��¹��ա�TiO2 ֱ�ӵ�ⷨ�����ѣ������Ϊ���ڵ��Ȼ��ƣ�ԭ����ͼ��ʾ��
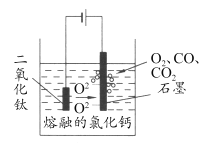
д�������缫��Ӧʽ___________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com