
【题目】在硝酸铝和硝酸镁的混合溶液中,逐滴加入稀氢氧化钠溶液,直至过量.下列表示氢氧化钠加入量(x)与溶液中沉淀的量(y)的关系示意图中正确的是( )
A.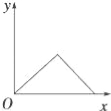 B.
B.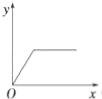 C.
C.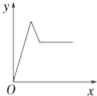 D.
D.
【答案】C
【解析】
试题分析:在硝酸铝和硝酸镁的混合溶液中,逐滴加入稀氢氧化钠溶液,首先发生反应:Al3++3OH﹣=Al(OH)3↓,Mg2++2OH﹣=Mg(OH)2↓,产生沉淀,随氢氧化钠溶液加入沉淀增大,当Al3+、Mg2+沉淀完全,沉淀最大,再加入氢氧化钠溶液,发生反应:Al(OH)3+OH﹣=AlO2﹣+2H2O,沉淀质量减小,最终沉淀为Mg(OH)2,再加入氢氧化钠溶液,沉淀质量不变,据此结合选项图象分析.
当Al3+沉淀完全时需加入6molOH﹣,即加入6molNaOH,生成Al(OH)32mol.
然后发生反应NH4++OH﹣=NH3H2O;NH4+完全反应时需加入2molOH﹣,即加入2molNaOH,沉淀氢氧化铝的量不变.
最后继续滴加NaOH,2molAl(OH)3溶解,发生反应Al(OH)3+OH﹣=AlO2﹣+2H2O,
当Al3+沉淀完全时需加入6molOH﹣,即加入6molNaOH,生成Al(OH)32mol.
然后发生反应NH4++OH﹣=NH3H2O;NH4+完全反应时需加入2molOH﹣,即加入2molNaOH,沉淀氢氧化铝的量不变.
最后继续滴加NaOH,2molAl(OH)3溶解,发生反应Al(OH)3+OH﹣=AlO2﹣+2H2O,直至过量.
解:在硝酸铝和硝酸镁的混合溶液中,逐滴加入稀氢氧化钠溶液,首先发生反应:Al3++3OH﹣=Al(OH)3↓,Mg2++2OH﹣=Mg(OH)2↓,产生沉淀,随氢氧化钠溶液加入沉淀增大,当Al3+、Mg2+沉淀完全,沉淀最大,再加入氢氧化钠溶液,发生反应:Al(OH)3+OH﹣=AlO2﹣+2H2O,沉淀质量减小,最终沉淀为Mg(OH)2,再加入氢氧化钠溶液,沉淀质量不变.
A、沉淀不能完全溶解,最终沉淀为Mg(OH)2,图象与实际不相符合,故A错误;
B、沉淀达最大量时,再加氢氧化钠溶液,氢氧化铝溶解,沉淀量减小,最后为定值,图象与实际不相符合,故B错误;
C、随氢氧化钠溶液加入沉淀增大,当Al3+、Mg2+沉淀完全,沉淀最大,再加入氢氧化钠溶液,发生反应:Al(OH)3+OH﹣=AlO2﹣+2H2O,沉淀质量减小,最后为定值,图象与实际相符合,故C正确;
D、当Al3+、Mg2+沉淀完全,沉淀最大,再加入氢氧化钠溶液,发生反应:Al(OH)3+OH﹣=AlO2﹣+2H2O,沉淀质量减小,最后为定值,图象与实际不相符合,故D错误.
故选:C.


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
【题目】下列各表中的数字代表的是元素的原子序数,表中数字所表示的元素与它们在周期表中的相对位置相符的是
( )
A.
3 | 5 | |
13 | ||
20 |
B.
1 | ||
4 | 5 | |
15 |
C.
1 | 2 | |
11 | ||
19 |
D.
8 | 10 | |
17 | ||
36 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通式为CnH2n-2的某烃在定容密闭容器中与足量O2完全燃烧,若反应前后压强不变(150℃),此烃分子式中n值为
A、2 B、3 C、4 D、5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2的催化氧化是工业制取硫酸的关键步骤之一,该反应的化学方程式为:2SO2+O2![]() 2SO3,
2SO3,
△H<0。请回答下列问题:
(1)判断该反应达到平衡状态的标志是__________(填字母)。
a.SO2和SO3浓度相等 b.SO2百分含量保持不变
c.容器中气体的压强不变 d.SO3的生成速率与SO2的消耗速率相等
(2)当该反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高SO2平衡转化率的
是______________(填字母)。
a.向装置中再充入N2 b.向装置中再充入O2
c.改变反应的催化剂 d.降低温度
(3)将0.050 mol SO2 (g)和0.030 mol O2 (g)放入容积为1L的密闭容器中,在一定条件下达到平衡,测得c(SO3) =0.040mol/L。计算该条件下反应的平衡常数K和SO2的转化率(不必写出计算过程)。
①平衡常数K=______________;
②平衡时,SO2的转化率α (SO2) =_____________。
(4)SO2尾气常用饱和Na2SO3溶液吸收,减少SO2气体污染并可得到重要的化工原料NaHSO3。己知NaHSO3溶液同时存在以下两种平衡:①HSO3-![]() SO32-+H+ ②HSO3-+H2O
SO32-+H+ ②HSO3-+H2O![]() H2SO3+OH-、常温下,0.1 mol/LNaHSO3溶液的 pH<7,则该溶液中 c (H2SO3)__________c (SO32-)(填“>”或“=”或“<”下同)。
H2SO3+OH-、常温下,0.1 mol/LNaHSO3溶液的 pH<7,则该溶液中 c (H2SO3)__________c (SO32-)(填“>”或“=”或“<”下同)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,反应A2+ B2![]() 2AB △H=QkJ/mol的反应时间与生成物AB的质量分数(AB%)的关系如图所示,其中a、b为不同温度时的反应曲线(其他条件不变),c为在t3时刻开始缩小容器容积(温度不变)的变化曲线。下列有关说法正确的是
2AB △H=QkJ/mol的反应时间与生成物AB的质量分数(AB%)的关系如图所示,其中a、b为不同温度时的反应曲线(其他条件不变),c为在t3时刻开始缩小容器容积(温度不变)的变化曲线。下列有关说法正确的是
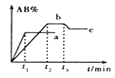
A. △H>0 B. AB一定是气体物质
C. 反应温度a低于b D. A2、B2中最少有一种是气态物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
有机物A~K有如下转化关系,E、H能与FeCl3溶液发生显色反应,I转化的产K只有一种结构,且K能使溴的CCl4溶液褪色。
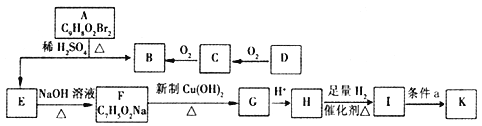
已知:① D的质谱与核磁共振氢谱图如下:
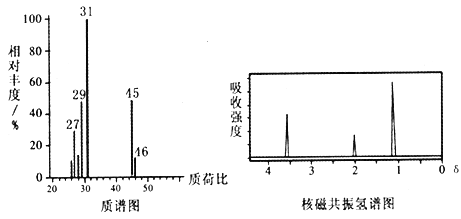
② 两个羟基同时连在同一碳原子上的结构是不稳定的,它将发生脱水反应:CH3CH(OH)2→CH3CHO + H2O。
请回答下列问题:
(1)C中官能团的名称是_______;H→I的反应类型是__________。
(2)K的结构简式为________;条件a为______。
(3)写出下列反应的化学方程式:
①F→G_________。
②A→B + E__________________。
(4)L是相对分子质量比H大14的同系物,同时符合下列条件L 的同分异构体有____种。
a.与FeCl3溶液有显色反应 b.能与NaHCO3溶液发生反应
其中苯环上的一溴代物只有两种的L的结构简式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种金属,进行如下实验:①将A与B浸在稀硫酸中用导线相连,A逐渐溶解,B上有气泡逸出;②将A、D分别投入等浓度盐酸中,D比A反应剧烈;③将B浸入C的盐溶液里,有金属C析出。据此判断它们的活动性由强到弱的顺序是
A.D>C>A>B B.D>A>B>C
C.D>B>A>C D.B>A>D>C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体X只可能由Al、(NH4)2SO4、MgCl2、FeCl2、AlCl3中的一种或几种组成,某同学对该固体进行了如下实验:
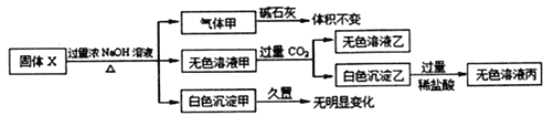
(1)若气体甲通过浓硫酸后体积减小,但还有剩余,则原混合物中一定存在的物质是___________,可能存在的物质是________________
(2)无色溶液甲通入过量的CO2,反应的离子方程式为________________________;
(3)在下图上画出无色溶液甲中逐滴滴加盐酸,生成白色沉淀与滴加盐酸的量关系示意图. ________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.加入过量氨水,有白色沉淀生成,则原溶液一定有Al3+
B.加入K3[Fe(CN)6]溶液,产生特征蓝色沉淀,则原溶液一定有Fe3+
C.加入盐酸酸化的BaCl2溶液,有白色沉淀生成,则原溶液一定有SO42-
D.加入NaOH溶液,产生气体使湿润的红色石蕊试纸变蓝,则原溶液一定有NH4+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com