
【题目】固体X只可能由Al、(NH4)2SO4、MgCl2、FeCl2、AlCl3中的一种或几种组成,某同学对该固体进行了如下实验:
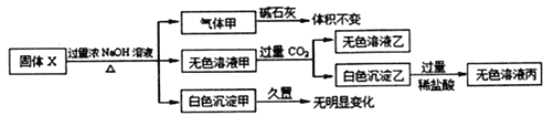
(1)若气体甲通过浓硫酸后体积减小,但还有剩余,则原混合物中一定存在的物质是___________,可能存在的物质是________________
(2)无色溶液甲通入过量的CO2,反应的离子方程式为________________________;
(3)在下图上画出无色溶液甲中逐滴滴加盐酸,生成白色沉淀与滴加盐酸的量关系示意图. ________________
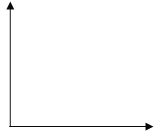
【答案】 Al、(NH4)2SO4 、MgCl2 AlCl3 OH-+ CO2= HCO3- [Al(OH)4]–+CO2=Al(OH)3↓+HCO3- 略。至少要体现2点:一是一开始加盐酸没有沉淀,二是生成最大值沉淀与沉淀消失所用盐酸体积为1:3
【解析】根据图像可知,固体X在过量浓NaOH溶液中加热后产生白色沉淀甲,甲久置无明显变化,证明沉淀为氢氧化镁,不含氢氧化亚铁,固体X中一定含有MgCl2,一定不含FeCl2,无色溶液甲通入过量CO2产生白色沉淀乙为氢氧化铝,说明溶液甲中含有NaAlO2,但NaAlO2也可能是由铝与氢氧化钠反应得到的,不能说明原溶液中一定含有AlCl3,无色溶液乙为碳酸氢钠溶液,白色沉淀乙与过量稀盐酸反应生成无色溶液丙为氯化铝,Al与氢氧化钠溶液反应产生氢气,(NH4)2SO4在氢氧化钠浓溶液加热条件下反应生成氨气,故气体甲可能是氢气、氨气中的一种或两种。
(1)若气体甲通过浓硫酸后体积减小,但还有剩余,则气体为氢气和氨气的混合物质,综上,原混合物中一定存在的物质是Al、(NH4)2SO4、MgCl2,可能存在的物质是AlCl3;(2)无色溶液甲(Na[Al(OH)4])通入过量的CO2生成Al(OH)3沉淀和NaHCO3,其反应的离子方程式为: [Al(OH)4]–+CO2=Al(OH)3↓+HCO3-;(3)无色溶液甲是过量的氢氧化钠和偏铝酸钠溶液的混合物,逐滴滴加盐酸,开始加盐酸与氢氧化钠反应没有沉淀,氢氧化钠消耗完后,加入的盐酸与偏铝酸钠反应产生氢氧化铝沉淀,偏铝酸钠反应完后,盐酸开始溶解氢氧化铝使沉淀溶解,且生成最大值沉淀与沉淀消失所用盐酸体积为1:3,示意图为:


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是核电荷数递增的5种短周期元素,原子半径按D、E、B、C、A递减,B、E同主族,则下列推断正确的是( )
A. A、B、E-定处于三个不同的短周期
B. A、D不可能在同一主族
C. C的最高价氧化物对应的水化物可能显碱性
D. C和D的单质不可能化合成1:1型离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在硝酸铝和硝酸镁的混合溶液中,逐滴加入稀氢氧化钠溶液,直至过量.下列表示氢氧化钠加入量(x)与溶液中沉淀的量(y)的关系示意图中正确的是( )
A.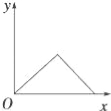 B.
B.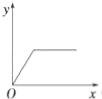 C.
C.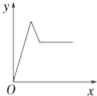 D.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某盐 A是由三种元素组成的化合物,某研究小组按如图流程探究其组成:
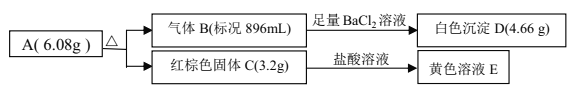
请回答:
(1)写出红棕色固体 C 的化学式____________。
(2)写出 A 受热分解反应的化学方程式____________。
(3)写出气体 B 与溶液 E 反应的离子方程式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 G(异戊酸薄荷醇酯)是一种治疗心脏病的药物。其合成线路如下:
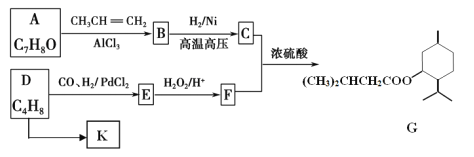
已知:①RCH=CH2+CO+H2![]() RCH2CH2CHO
RCH2CH2CHO
②A能与 FeCl3发生显色反应, K是高分子化合物
③![]()
请填写下列空白:
(1)F中官能团名称_____,A到B的反应类型________。
(2)写出C和F反应生成G的化学方程式___________。
(3)下列说法正确的是_______。
A.有机物 G 的分子式为 C15H28O2
B.有机物 A 溶液能与 Na2CO3 溶液反应产生 CO2
C.有机物 C 不能与浓溴水反应生成白色沉淀
D.有机物 D 生成 K 的反应为缩聚反应
(4)某芳香族化合物 X是B的同分异构体,X分子中含有4种不同化学环境的氢原子,其对应的个数比为 9:2:2:1,写出该化合物可能的结构简式_________。
(5)正戊酸的化学式为CH3(CH2)3COOH,可用作香料、橡胶促进剂等,写出以正丁醇(CH3CH2CH2CH2OH)为原料制备正戊酸的合成路线流程图(无机试剂任用)。
__________
合成路线流程图示例如下:
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】各组物质不属于同分异构体的是( )
A.2,2-二甲基-1-丙醇和2-甲基-1-丁醇
B.对氯甲苯和邻氯甲苯
C.2-甲基丁烷和戊烷
D.甲基丙烯酸和甲酸丙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛白粉(金红石晶型 TiO2)被广泛用于制造高级白色油漆。工业上以钛铁矿(主要成分为 FeTiO3,含有 Fe2O3 和 SiO2 等杂质)为原料制钛白粉的主要工艺如下:
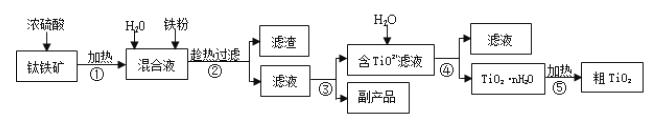
回答下列问题:
(1)第②步所得滤渣的成分是________。
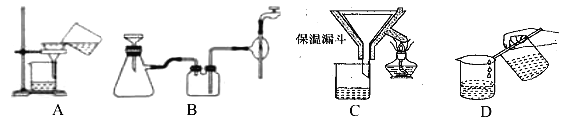
(2)操作④中需要控制条件以形成 TiO2·nH2O 溶胶,该工艺过程若要在实验室里完成,其中的“过滤”操作,可选用下列装置________(填选项)。
(3)第③步的实验操作是______、过滤,从而获得副产品 FeSO4·7H2O。
(4)为测定操作③所得滤液中TiO2+的浓度,取待测滤液10 mL 用蒸馏水稀释至100 mL,加入过量铝粉,充分振荡,使其完全反应:3TiO2+ + Al + 6H+ = 3Ti3+ + Al3+ + 3H2O。过滤后,取出滤液20.00 mL(加铝粉时引起溶液体积的变化忽略不计),向其中滴加2~3 滴KSCN溶液作指示剂,用 0.1000 mol·L-1NH4Fe(SO4)2 标准溶液滴定至溶液出现红色,此时溶液中 Ti3+全部被氧化为 Ti4+,消耗标准液30.00mL。回答下列问题:
①下列操作会使所测 TiO2+浓度偏高的是______。
A. 在配制标准液的过程中,未洗涤烧杯和玻璃棒
B. 在配制标准液定容是俯视刻度线
C.用蒸馏水洗涤后未经润洗的滴定管取待测液
D.在滴定终点读数时仰视滴定管刻度线
②求得待测滤液中 TiO2+的物质的量浓度是______。
(5)科学家从电解冶炼铝的工艺中得到启发,找出了冶炼钛的新工艺—TiO2 直接电解法生产钛,电解质为熔融的氯化钙,原理如图所示。
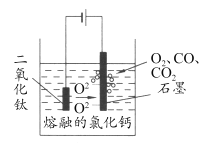
写出阴极电极反应式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中,若忽略水的电离,只含有下表中所示的四种离子,.则表中X离子种类及其个数b为
离子种类 | Na+ | Al3+ | Cl- | X |
个数 | 2a | a | a | b |
A. NH4+、4a B. SO42-、2a C. OH-、4a D. CO32-、2a
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com