
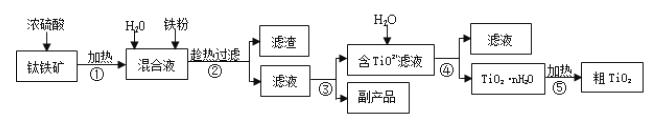
����Ŀ���Ѱۣ����ʯ���� TiO2�����㷺�����������ɫ���ᡣ��ҵ������������Ҫ�ɷ�Ϊ FeTiO3������ Fe2O3 �� SiO2 �����ʣ�Ϊԭ�����Ѱ۵���Ҫ�������£�
�ش��������⣺
��1���ڢڲ����������ijɷ���________��
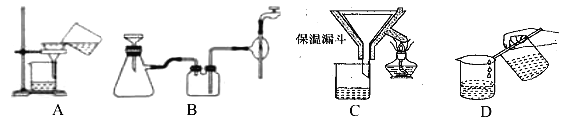
��2������������Ҫ�����������γ� TiO2��nH2O �ܽ����ù��չ�����Ҫ��ʵ��������ɣ����еġ����ˡ���������ѡ������װ��________����ѡ���
��3���ڢ۲���ʵ�������______�����ˣ��Ӷ���ø���Ʒ FeSO4��7H2O��
��4��Ϊ�ⶨ������������Һ��TiO2+��Ũ�ȣ�ȡ������Һ10 mL ������ˮϡ����100 mL������������ۣ������ʹ����ȫ��Ӧ��3TiO2+ + Al + 6H+ = 3Ti3+ + Al3+ + 3H2O�����˺�ȡ����Һ20.00 mL��������ʱ������Һ����ı仯���Բ��ƣ��������еμ�2��3 ��KSCN��Һ��ָʾ������ 0.1000 mol��L-1NH4Fe(SO4)2 ����Һ�ζ�����Һ���ֺ�ɫ����ʱ��Һ�� Ti3+ȫ��������Ϊ Ti4+�����ı�Һ30.00mL���ش��������⣺
�����в�����ʹ���� TiO2+Ũ��ƫ�ߵ���______��
A. �����Ʊ�Һ�Ĺ����У�δϴ���ձ��Ͳ�����
B. �����Ʊ�Һ�����Ǹ��ӿ̶���
C��������ˮϴ�Ӻ�δ����ϴ�ĵζ���ȡ����Һ
D���ڵζ��յ����ʱ���ӵζ��̶ܿ���
����ô�����Һ�� TiO2+�����ʵ���Ũ����______��
��5����ѧ�Ҵӵ��ұ�����Ĺ����еõ��������ҳ���ұ���ѵ��¹��ա�TiO2 ֱ�ӵ�ⷨ�����ѣ������Ϊ���ڵ��Ȼ��ƣ�ԭ����ͼ��ʾ��
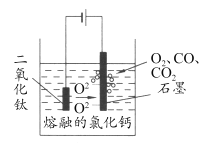
д�������缫��Ӧʽ___________��
���𰸡�Fe��SiO2C����Ũ������ȴ�ᾧAD1.500 mol��L��1TiO2��4e��=Ti��2O2��
��������
(1)�������к��е� SiO2 ���������ᣬ�ӻ��Һ�м����˹�����Fe�ۣ���ԭ��Һ�е�Fe3+������������������ijɷ���SiO2 ������Fe��
(2)����������Ҫ�����¶����γ� TiO2��nH2O �ܽ�����Ӧѡ����©����ɡ����ˡ���������ѡ��C�������⣬��ΪC��
(3)��������������Һͨ������ ����Ũ������ȴ�ᾧ���ٹ��ˣ��ɵõ�FeSO4��7H2O��
(4)��A�������Ʊ�Һ�Ĺ����У�δϴ���ձ��Ͳ���������Һ��Ũ�Ƚ��ͣ����ĵı�Һ������������� TiO2+Ũ��ƫ�ߣ���A��ȷ��B�������Ʊ�Һ�����Ǹ��ӿ̶��ߣ���Һ���ƫС����Һ��Ũ�Ƚ������ĵı�Һ�����С���������� TiO2+Ũ��ƫ�ͣ���B����C��������ˮϴ�Ӻ�δ����ϴ�ĵζ���ȡ����Һ������Һ��ˮϡ�ͣ�Ũ��ƫ�ͣ���C����D���ڵζ��յ����ʱ���ӵζ��̶ܿ��ߣ���Һ�����ƫ�������� TiO2+Ũ��ƫ�ߣ���D��ȷ����ΪAD��
�����ı�Һ�����ʵ���Ϊ 0.1000 mol��L-1��0.03 L=3��10-3 mol�����ݵ����غ㣬��֪��Һ��Ti3+�����ʵ���Ϊ3��10-3 mol������Һ��TiO2+�����ʵ���Ϊ3��10-3 mol����Һ�� TiO2+�����ʵ���Ũ����3��10-3 mol��0.02 L=1.500 mol��L��1��
(5)���ʱ�������ϵõ��ӷ�����ԭ��Ӧ�����Զ������ѵõ��������Ѻ������ӣ��͵�Դ�����������缫��ӦʽΪTiO2+4e-=Ti+2O2-��


 ��ͼͼ�麮����ҵ������ҵ���ִ�ѧ������ϵ�д�
��ͼͼ�麮����ҵ������ҵ���ִ�ѧ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��SO2�Ĵ������ǹ�ҵ��ȡ����Ĺؼ�����֮һ���÷�Ӧ�Ļ�ѧ����ʽΪ��2SO2+O2![]() 2SO3��
2SO3��
��H<0����ش��������⣺
��1���жϸ÷�Ӧ�ﵽƽ��״̬�ı�־��__________(����ĸ����
a.SO2��SO3Ũ����� b.SO2�ٷֺ������ֲ���
c.�����������ѹǿ���� d.SO3������������SO2�������������
��2�����÷�Ӧ����ƽ��״̬ʱ�����������������£����д�ʩ�����������SO2ƽ��ת���ʵ�
��______________(����ĸ)��
a.��װ�����ٳ���N2 b.��װ�����ٳ���O2
c.�ı䷴Ӧ�Ĵ��� d.�����¶�
��3����0.050 mol SO2 (g)��0.030 mol O2 (g)�����ݻ�Ϊ1L���ܱ������У���һ�������´ﵽƽ�⣬���c(SO3) =0.040mol/L������������·�Ӧ��ƽ�ⳣ��K��SO2��ת����(����д���������)��
��ƽ�ⳣ��K=______________��
��ƽ��ʱ��SO2��ת������ (SO2) =_____________��
��4��SO2β�����ñ���Na2SO3��Һ���գ�����SO2������Ⱦ���ɵõ���Ҫ�Ļ���ԭ��NaHSO3����֪NaHSO3��Һͬʱ������������ƽ�⣺��HSO3-![]() SO32-+H+ ��HSO3-+H2O
SO32-+H+ ��HSO3-+H2O![]() H2SO3+OH-�������£�0.1 mol/LNaHSO3��Һ�� pH<7�������Һ�� c (H2SO3)__________c (SO32-)(����>������=������<����ͬ����
H2SO3+OH-�������£�0.1 mol/LNaHSO3��Һ�� pH<7�������Һ�� c (H2SO3)__________c (SO32-)(����>������=������<����ͬ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Xֻ������Al��(NH4)2SO4��MgCl2��FeCl2��AlCl3�е�һ�ֻ�����ɣ�ijͬѧ�Ըù������������ʵ�飺
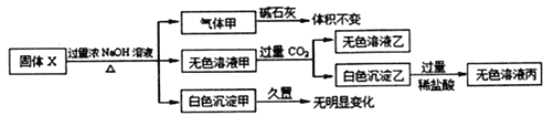
��1���������ͨ��Ũ����������С��������ʣ�࣬��ԭ�������һ�����ڵ�������___________�����ܴ��ڵ�������________________
��2����ɫ��Һ��ͨ�������CO2����Ӧ�����ӷ���ʽΪ________________________;
��3������ͼ�ϻ�����ɫ��Һ������εμ����ᣬ���ɰ�ɫ������μ����������ϵʾ��ͼ. ________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��д��ȷ����
A. ����������Һ��Ӧ��2Fe + 6H+ === 2Fe3+ +3 H2��
B. ������ˮ��Ӧ��Cl2 + H2O![]() 2 H+ + Cl- + ClO
2 H+ + Cl- + ClO
C. ����������Һ������ͭ��Һ��Ӧ��Ba2+ + SO42- = BaSO4��
D. �Ȼ�����Һ�백ˮ��Һ��Ӧ�� Fe3+ + 3 NH3��H2O === Fe (OH)3 ��+ 3NH4+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȥ�������������������ʣ�ѡ�õ��Լ���ȷ����
ѡ�� | ���ʣ����ʣ� | �Լ� |
A | Al2O3(SiO2) | NaOH��Һ |
B | CO2(SO2) | Na2CO3��Һ |
C | NO(NO2) | ˮ |
D | NaHCO3(Na2CO3) | Ca(OH)2��Һ |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A��ֻ��һ��Ԫ�ص�����һ���ǵ��� B��ֻ��һ�ַ��ӵ�����һ��������
C���ǽ���������һ�������������� D���е������ɵķ�Ӧһ�����û���Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A�����������ˮ���а�ɫ�������ɣ���ԭ��Һһ����Al3+
B������K3[Fe(CN)6]��Һ������������ɫ��������ԭ��Һһ����Fe3+
C�����������ữ��BaCl2��Һ���а�ɫ�������ɣ���ԭ��Һһ����SO42��
D������NaOH��Һ����������ʹʪ��ĺ�ɫʯ����ֽ��������ԭ��Һһ����NH4+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ũ��SO2�����Ĵ����ǹ�ҵ���⣬��ҵ�ϳ����÷ϼ�������Ҫ�ɷ�Na2CO3���������᳧β���е�SO2�Ʊ���ˮNa2SO3�ijɱ��ͣ��������ԣ����������¡�
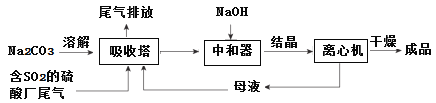
��1��Ϊ��ʹSO2������������ȫ���ڲ��ı�����������������£����Բ�ȡ�ĺ�
����ʩ______________��_______________����д��������
��2���к����з�������Ҫ��Ӧ�����ӷ���ʽ��_____________________��
��3����ͼΪ��������Na2CO3��Һ��SO2��Ӧ��������Һ��ɱ仯��
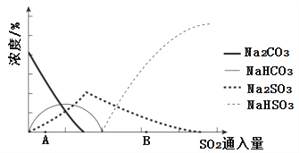
������ڷ�Ӧ��ͼ��A����ǰ���Ļ�ѧ����ʽ��__________________��
��ͨ����ⷨ�ɷ���ͼ��B��NaHSO3��Na2SO3����ʵ��Na2SO3��ѭ�����ã�ʾ��ͼ���£�
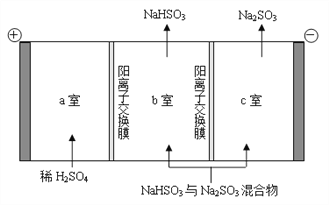
��������NaHSO3��Na2SO3������ԭ��___________________��
��4����ͼ���������Ƶ��ܽ�����ߣ��¶���33��ǰ���Ӧ��ͬ���ʣ�������˵����ȷ����______
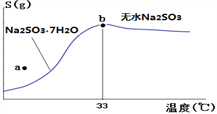
A��a��ʱ��ҺΪ��������Һ
B��b��ʱNa2SO3��7H2O����ˮNa2SO3����
C���Ʊ���ˮNa2SO3��Ӧ����95~100�����Ũ������ȴ�����½ᾧ
��5������ú������ʵ������ʵ����и���Һ�ֱ�����SO2��������������������__________
A��Na2SO3 B��Na2S C��Ba(NO3)2 D������KMnO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧ����ʵ�鱨�����г������������к�������( )
A����10mL��Ͳ��ȡ7.13mLϡ����
B����������ƽ����25.20g NaCl
C���ù㷺pH��ֽ���ij��Һ��pHΪ2.3
D����25mL�ζ������к͵ζ�ʱ����ȥijŨ�ȵļ���Һ21.70mL
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com