
【题目】金银花有效活性成分为绿原酸,又名咖啡鞣酸,具有广泛的杀菌消炎功效,结构如图所示,下列有关绿原酸的说法正确的是( )
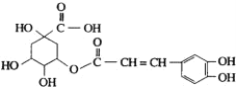
A. 绿原酸的分子式为C16H8O9
B. 1mol 绿原酸最多与7molNaOH反应
C. 1个绿原酸分子最多与4mol氢气反应
D. 绿原酸分子中有4种化学环境不同的氢原子
科目:高中化学 来源: 题型:
【题目】![]() 是一种放射性核素,可治疗多种皮肤病。下列有关该核素说法正确的是
是一种放射性核素,可治疗多种皮肤病。下列有关该核素说法正确的是
A. ![]() 的摩尔质量是32
的摩尔质量是32
B. ![]() 和
和![]() 互称为同位素
互称为同位素
C. 1mol ![]() 含质子数约为32×6.02×1023
含质子数约为32×6.02×1023
D. 由质量数可以判断其在周期表的位置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室备有质量分数为98%,密度为1.84 g·cm-3的硫酸,据此下列说法错误的是 ( )
A. 该硫酸的物质的量浓度为18.4 mol·L-1
B. 该硫酸50 mL与足量的铜反应可得到标准状况下SO2 0.46 mol
C. 某同学用该硫酸配制稀硫酸时,未洗涤烧杯和玻璃棒,会造成最终配制的稀硫酸浓度偏低
D. 等质量的水与该硫酸混合所得溶液的物质的量浓度小于9.2 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E均是短周期主族元素,其原子序数依次增大,A和B同周期,A和D同主族,A原子最外层电子数是内层电子数的二倍,B元素族序数是周期数的三倍,B的阴离子与C的阳离子电子层结构相同,C的单质与B的单质在不同条件下反应,可生成C2B或C2B2,E是所在周期中原子半径最小的元素,请回答:
(1)D在元素周期表中的位置是___________。
(2)C2B2的电子式是________。
(3)B、C、E的离子半径由大到小的顺序为________(用离子符号回答);A、D、E元素最高价氧化物对应水化物的酸性由强到弱为_________(用化学式回答,下同),B的气态氢化物与H2S相比沸点高的是_____,原因是___________________________。
(4)写出D的氧化物与氢氟酸反应的化学方程式____________________________________。
(5)1mol C2B2与足量的水反应转移电子的物质的量是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对图像的叙述正确的是
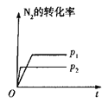
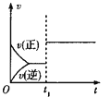
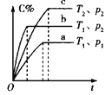

甲 乙 丙 丁
A.图甲可表示压强对反应:![]()
![]() 的影响
的影响
B.图乙中,![]() 时刻改变的条件一定是加入了催化剂
时刻改变的条件一定是加入了催化剂
C.若图丙表示反应:![]() ,则
,则![]() 、
、![]()
D.图丁表示水中![]() 和
和![]() 的关系,ABC所在区域总有
的关系,ABC所在区域总有![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物贝诺酯可由乙酰水杨酸和对乙酰氨基酚在一定条件下反应制得:

下列有关叙述正确的是( )
A. 贝诺酯分子中有三种含氧官能团
B. 可用FeCl3溶液区别乙酰水杨酸和对乙酰氨基酚
C. 乙酰水杨酸和对乙酰氨基酚均能与NaHCO3溶液反应
D. 贝诺酯与足量NaOH 溶液共热,最终生成乙酰水杨酸钠和对乙酰氨基酚钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:![]() +CH3CHO+HBr
+CH3CHO+HBr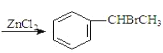 +H2O(卤烷基化反应);
+H2O(卤烷基化反应);
![]() +
+![]()
![]()
![]() +NaX
+NaX
用苯为原料合成化合物Ⅳ的线路如下:
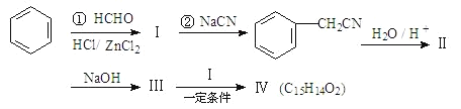
其中:Ⅱ是羧酸。请回答下列问题:
(1)②的反应类型是________。
(2)写出同时符合下列条件的化合物Ⅱ的同分异构体结构简式(写2种)_____、_____。
a.能与FeCl3溶液作用显紫色;
b.能发生银镜反应;
c.核磁共振氢谱除苯环峰外还有三组峰,峰面积之比为为 1:2:1。
(3)1mol化合物Ⅳ完全燃烧消耗O2_____mol,化合物Ⅳ的结构简式是__________。
(4)化合物Ⅱ与乙醇、浓硫酸共热,合成一种香精原料,试写出该反应的化学方程式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O5是一种新型硝化剂,其性质和制备受到人们的关注。已知N2O5能与水发生反应,并放出大量的热。
Ⅰ.一定温度下,在恒容密闭容器中N2O5发生下列反应:2N2O5(g)![]() 4NO2(g)+O2(g)ΔH。
4NO2(g)+O2(g)ΔH。
(1)下表为反应在T1温度下的部分实验数据:
t/s | 0 | 500 | 1000 |
c(N2O5)/mol·L—1 | 5.00 | 3.52 | 2.48 |
则500s内NO2的生成速率为______________。
(2)反应达到平衡后,若再通入一定量N2O5,达到新平衡时,N2O5的转化率将______(填“增大”、“减小”、“不变”)。
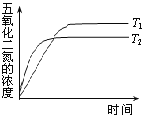
(3)在温度T1和T2时,N2O5的浓度与反应时间的关系如图所示。据此判断:T1______T2(填“>”、“<”或“=”,下同),ΔH______0。
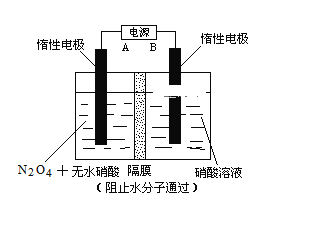
Ⅱ.下图所示装置,可用于制备N2O5气体。A是电源的____________(填“负极”或“正极”),电解池的阳极反应式为______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4(其中C为-4价)既是一种重要的能源,也是一种重要的化工原料。
(1)已知8.0gCH4完全燃烧生成二氧化碳和液态水时放出444.8kJ热量。若一定量的甲烷完全燃烧生成二氧化碳和液态水时放出1334.4kJ的热量,则需要标准状况下的氧气约___L。
(2)以CH4为燃料可设计成结构简单、能量转化率高、对环境无污染的燃料电池,其工作原理如图甲所示,通入2.24L(已换算为标准状况)a气体时,通过质子交换膜转移的H+数目为___(设NA为阿伏加德罗常数的值)。

(3)在一定温度和催化剂作用下,CH4与CO2可直接转化成乙酸,这是实现“减排”的一种研究方向。
①在不同温度下,催化剂的催化效率与乙酸的生成速率如图乙所示,则该反应的最佳温度应控制在___℃左右。
②该反应催化剂的有效成分为偏铝酸亚铜(CuAlO2,难溶物)。将CuAlO2溶解在稀硝酸中生成两种盐并放出NO气体,其反应的离子方程式为___。
③CH4还原法是处理NOx气体的一种方法。已知一定条件下CH4与NOx反应转化为N2、CO2和H2O,若标准状况下8.96LCH4可处理22.4LNOx,则x值为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com