
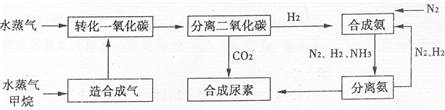
我国有丰富的天然气资源。以天然气为原料合成尿素的主要步骤如下图所示(图中某些转化步骤及生成物未列出):

(1)“造合成气”发生的热化学方程式是CH4(g)+H2O(g)  CO(g)+3H2(g);△H>0
CO(g)+3H2(g);△H>0
在恒温恒容的条件下,欲提高CH4的反应速率和转化率,下列措施可行的是 。
A、增大压强 B、升高温度 C、充入He气 D、增大水蒸气浓度
(2)“转化一氧化碳”发生的方程式是H2O(g) +CO(g)  H2(g)+CO2(g),该反应平衡常数随温度的变化如下:
H2(g)+CO2(g),该反应平衡常数随温度的变化如下:
|
温度/℃ |
400 |
500 |
800 |
|
平衡常数K |
9.94 |
9 |
1 |
提高氢碳比[ n(H2O)/n(CO)],K值 (填“增大”、“不变”或“减小”);若该反应在400℃时进行,起始通入等物质的量的H2O和CO,反应进行到某一时刻时CO和CO2的浓度比为1∶3,此时v(正) v(逆)(填“>”、“=”或“<”)。
(3)有关合成氨工业的说法中正确的是 。
A、该反应属于人工固氮
B、合成氨工业中使用催化剂能提高反应物的利用率
C、合成氨反应温度控制在500℃左右,目的是使化学平衡向正反应方向移动
D、合成氨工业采用循环操作的主要原因是为了加快反应速率
(4)生产尿素过程中,理论上n(NH3)∶n(CO2)的最佳配比为 ,而实际生产过程中,往往使n(NH3)∶n(CO2)≥3,这是因为 。
(5)当甲烷合成氨气的转化率为60%时,以3.0×108 L甲烷为原料能够合成 L 氨气。(假设体积均在标准状况下测定)
(1)B D (选对1个得1分,只要选错得0分)
(2)不变;> (3)A
(4)2:1;有利于提高CO2的转化率,因为NH3极易溶于水,便于分离、回收利用
(5)4.8×108
【解析】
试题分析:(1)A、增大压强,反应速率加快,平衡向逆反应方向移动,甲烷的转化率降低,故A错误;
B、升高温度,反应速率加快,平衡向正反应方向移动,甲烷的转化率增大,故B正确;
C、充入He气,反应混合物的浓度不变,反应速率不变,平衡不移动,甲烷的转化率不变,故C错误;
D、增大水蒸气浓度,反应速率加快,平衡向逆反应方向移动,甲烷的转化率增大,故D正确;
故答案为:BD;
(2)平衡常数只受温度影响,与反应物的浓度无关,提高氢碳比(2)平衡常数只受温度影响,与反应物的浓度无关,提高氢碳比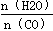 ,K值不变;
,K值不变;
令开始H2O和CO的物质的量都是1mol,某一时刻时CO和CO2的浓度比为1:3,设此时参加反应CO为xmol,则(1-x):x=1:3,解得x=0.75,则:
H2O(g)+CO(g) H2(g)+CO2(g),
H2(g)+CO2(g),
开始(mol):1 1 0 0
变化(mol):0.75 0.75 0.75 0.75
某时刻(mol):0.25 0.25 0.75 0.75
故产生浓度商Qc= <9.94,反应向正反应进行,故v(正)>v(逆),
<9.94,反应向正反应进行,故v(正)>v(逆),
故答案为:不变;>;
(3)A.固氮指由游离态的氮转化为化合态的氮,合成氨属于人工固氮,故A正确;
B.催化剂加快反应速率,不能影响平衡移动,不能提高反应物的利用率,故B错误;
C.该反应正反应是放热反应,高温不利用氨气的合成,合成氨反应温度控制在500℃左右,在该温度下反应速率较快、催化剂活性较高,故C错误;
D.合成氨工业采用循环操作,目的是提高原料的利用率,故D错误;
故答案为:A;
(4)根据尿素的化学式CO(NH2)2,C、N原子完全利用最后,由C、N原子守恒可知生产尿素过程中,理论上n(NH3):n(CO2)的最佳配比为2:1;
往往使n(NH3):n(CO2)≥3,这是由于:有利于提高CO2的转化率,且NH3极易溶于水,便于分离、回收利用;
故答案为:2:1;有利于提高CO2的转化率,且NH3极易溶于水,便于分离、回收利用;
(5)由CH4(g)+H2O(g) CO(g)+3H2(g),N2(g)+3H2(g)
CO(g)+3H2(g),N2(g)+3H2(g) 2NH3(g),可得CH4(g)~3H2(g)~2NH3(g),设能够合成氨气的体积为VL,则:
2NH3(g),可得CH4(g)~3H2(g)~2NH3(g),设能够合成氨气的体积为VL,则:
CH4(g)~3H2(g)~2NH3(g),
1 2
3.0×108L×60% VL
故V=3.0×108L×60%×2=3.6×108L
合成气的反应中:CH4 ~ CO ~ 3H2,
3.0×108L×60% 3.0×108L×60% 3.0×108L×60%×3
分离二氧化碳过程生成的H2体积:CO ~ H2,
3.0×108L×60% 3.0×108L×60%
所以产生的氢气的总体积为3.0×108L×60%×3+3.0×108L×60%=12×108L×60%
令产生氨气的体积为V,则:
3H2 ~ 2NH3
3 2
12×108L×60% V
故V=12×108L×60%×2/3
=4.8×108L
故答案为:4.8×108.
考点:化学平衡的影响因素;化学平衡的调控作用


科目:高中化学 来源: 题型:
| ||
| ||
| ||
| ||
| c(CO)?c3(H2) |
| c(CH4)?c(H2O) |
| c(CO)?c3(H2) |
| c(CH4)?c(H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省扬州市高二下学期期末考试化学试卷(带解析) 题型:填空题
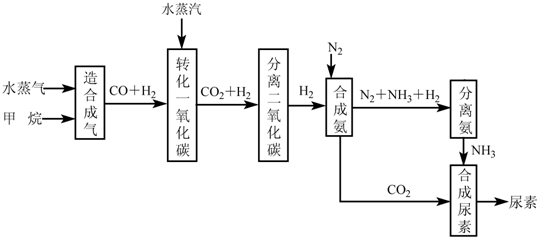
我国有丰富的天然气资源。以天然气为原料合成尿素的主要步骤如下图所示(图中某些转化
步骤及生成物未列出):
(1)“造合成气”发生的热化学方程式是CH4(g)+H2O(g)  CO(g)+3H2(g);△H>0在恒温恒容的条件下,欲提高CH4的反应速率和转化率,下列措施可行的是 。
CO(g)+3H2(g);△H>0在恒温恒容的条件下,欲提高CH4的反应速率和转化率,下列措施可行的是 。
A、增大压强 B、升高温度 C、充入He气 D、增大水蒸气浓度
(2)“转化一氧化碳”发生的方程式是H2O(g) +CO(g)  H2(g)+CO2(g),该反应平衡常数随温度的变化如下:
H2(g)+CO2(g),该反应平衡常数随温度的变化如下:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com