
| A. | 进行分液操作时,应先打开上口活塞或使塞上的凹槽对准漏斗口的小孔,然后打开旋塞,下层液体从下口放出,上层液体从漏斗上口倒出 | |
| B. | 纸层析法是以滤纸为惰性支持物,水为固定相,有机溶剂作流动相.用该方法可分离Fe3+和Cu2+,层析后氨熏显色,滤纸上方出现红棕色斑点 | |
| C. | 酸式滴定管、碱式滴定管、容量瓶、移液管都是准确量取一定体积液体的容器,它们在使用时都要进行检查是否漏水、水洗、润洗、注液、调整液面等几个过程 | |
| D. | 在制备硝酸钾晶体的实验中,趁热过滤时,承接滤液的小烧杯中预先加2mL蒸馏水.以防过滤时氯化钠晶体析出 |
分析 A.依据分液漏斗的使用方法解答;
B.纸层析法是利用离子在滤纸上的移动速度不同,进行分离,铁离子在上层,遇到氨水生成红褐色沉淀氢氧化铁;
C.依据酸式滴定管、碱式滴定管、容量瓶、移液管的装置特点和使用注意事项解答;
D.制备KNO3利用的是硝酸钾和氯化钠溶解度随温度改变而发生不同变化的原理解答.
解答 解:A.进行分液操作时,应先打开上口活塞或使塞上的凹梢对准漏斗口的小孔,然后打开旋塞,下层液体从下口放出,上层液体从漏斗上口倒出符合实验基本操作,故A正确;
B.纸层析法是以滤纸为惰性支持物,水为固定相,有机溶剂作流动相.用该方法可分离Fe3+和Cu2+,纸层析法是利用离子在滤纸上的移动速度不同,进行分离,铁离子在上层,遇到氨水生成红褐色沉淀氢氧化铁层析后氨熏显色,滤纸上方出现红棕色斑点,故B正确;
C.容量瓶为配置一定物质的量浓度溶液的主要仪器,使用时不能润洗,故C错误;
D.在制备硝酸钾晶体的实验中,利用的是硝酸钾和氯化钠溶解度随温度改变而发生不同变化的原理,所以不应该趁热过滤,故D错误;
故选CD.
点评 本题为实验题,考查了常见仪器的使用和常见实验的原理,侧重于学生的分析能力、实验能力的考查,题目难度不大.


 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 甲=乙=丙 | B. | 丙>乙>甲 | C. | 乙>丙>甲 | D. | 甲=丙>乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
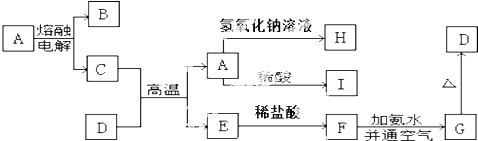
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
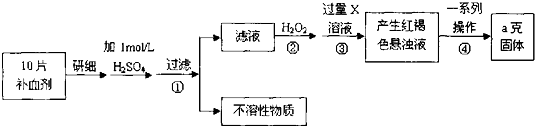
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲、乙两池电极材料都是铁棒与碳棒(如图).请回答下列问题:
甲、乙两池电极材料都是铁棒与碳棒(如图).请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3p3表示3p能级有三个轨道 | |
| B. | 基态碳原子的价电子排布图: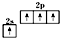 | |
| C. | 冰和固体碘晶体中相互作用力不完全相同 | |
| D. | 某气态团簇分子结构如图所示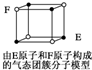 ,该气态团簇分子的分子式为EF或FE ,该气态团簇分子的分子式为EF或FE |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
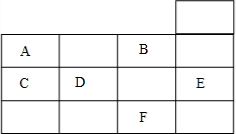
| A. | 常压下六种元素的单质中,F单质的沸点最高 | |
| B. | 晶体E中不存在化学键 | |
| C. | D元素的非金属性比B元素的非金属性强 | |
| D. | 单质A、C均没有同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2HgO$\frac{\underline{\;\;△\;\;}}{\;}$2Hg+O2↑ | B. | 2Al+3MnO2$\frac{\underline{\;高温\;}}{\;}$2Al2O3+3Mn | ||
| C. | 2MgO$\frac{\underline{\;电解\;}}{\;}$2Mg+O2↑ | D. | 4CO+Fe3O4$\frac{\underline{\;高温\;}}{\;}$3Fe+4CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

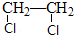 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com