
【题目】向盛有FeCl2溶液的试管中,滴加几滴KSCN溶液,无明显变化,再加入下列哪种试剂溶液会变红( )
A.铁粉B.双氧水C.稀盐酸D.氨水
科目:高中化学 来源: 题型:
【题目】同温同压下,某容器充满N2重114 g,若充满He重102 g,现充满某气体重116 g,则该气体的相对分子质量为( )
A. 101 B. 17 C. 32 D. 10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某溶液中滴加NaOH溶液产生白色沉淀,维续滴加沉淀溶解。该溶液可能是( )
A.MgCl2溶液B.AlCl3溶液C.FeCl2溶液D.FeCl3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关浓硫酸的性质或作用,叙述错误的是
A.浓硫酸的脱水性是化学性质
B.使铁、铝钝化表现了强氧化性
C.制备乙酸乙酯的反应中起催化吸水作用
D.与氯化钠固体共热制氯化氢气体时,表现强酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏伽德罗常数的值为NA,下列说法正确的是
A. 1L 1mol/L FeCl3溶液中,Fe3+的数目为NA
B. 101g 一氯甲烷中含有C-H键的数目为8NA
C. 标准状况下,22.4L 氨气含有电子数为 10NA
D. 1mol 过氧化钠与足量水完全反应,转移的电子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 阴离子只有还原性
B. 含有最高价元素的化合物,只有氧化性,不具有还原性
C. Zn和稀硫酸反应既属于离子反应,也属于氧化还原反应
D. 没有单质参加也没有单质生成的反应一定不是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。实验室用足量NaOH溶液吸收从浓盐酸和MnO2反应体系中导出的气体。当吸收温度不同时,生成的产物可能是NaClO、NaClO3、NaCl中的两种或三种。下列说法正确的是
MnCl2+Cl2↑+2H2O。实验室用足量NaOH溶液吸收从浓盐酸和MnO2反应体系中导出的气体。当吸收温度不同时,生成的产物可能是NaClO、NaClO3、NaCl中的两种或三种。下列说法正确的是
A. 若产物为NaClO、NaCl,则吸收后的溶液中n(ClO-)=n(Cl-)
B. 若产物为NaClO3、NaCl,则参加反应的氧化剂和还原剂的物质的量之比为1∶5
C. 若产物为NaClO、NaClO3、NaCl,则由吸收后的溶液中n(Cl-)和n(ClO-)可计算吸收的n(Cl2)
D. 若产物为NaClO、NaClO3、NaCl,则NaOH与Cl2相互反应的物质的量之比为2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁铝合金在工业上有着广泛的用途,氧化铝是冶炼金属铝的主要原料。从铝土矿(主要成分是Al2O3,含有SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下:
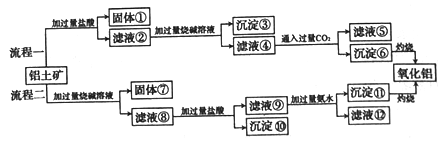
回答下列问题:
(1)Al2O3、SiO2、Fe2O3、MgO四种物质中,属于酸性氧化物的是______,属于碱性氧化物的是______。
(2)流程一中,沉淀③是_________(填化学式,下同),沉淀⑥是_________。
(3)流程二中,加入烧碱溶解SiO2的化学方程式为_________。
(4)滤液⑤中的可溶性盐是NaCl、______(填化学式),滤液⑨与过量氨水反应的离子方程式为_____。
(5)在电解氧化铝制取金属铝的反应中,氧化产物与还原产物的质量之比为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据相关计算填空
①19.6克硫酸是 mol H2SO4 , 含有 个原子,1.7克NH3在同温同压下与 克H2S气体含有的氢原子数相同.
②在标准状况下,1.6g某气态氧化物RO2体积为0.56L,该气体的物质的量是 摩尔质量是 ,R的相对原子量为
③已知Wg气体A含有a个分子,那么在标准状况下,bg气体A所占的体积是 (其中阿伏加德罗常数用NA表示)
④标准状况下,密度为0.75g/L的NH3与CH4组成的混合气体中,NH3的体积分数 ,混合气体的平均摩尔质量为 该气体对氢气的相对密度为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com