
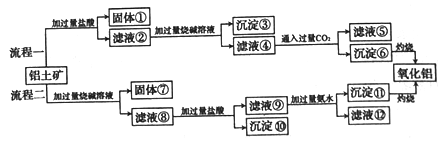
����Ŀ��þ���Ͻ��ڹ�ҵ�����Ź㷺����;����������ұ������������Ҫԭ�ϡ�����������Ҫ�ɷ���Al2O3������SiO2��Fe2O3��MgO�����ʣ�����ȡ�����������ֹ����������£�
�ش��������⣺
��1��Al2O3��SiO2��Fe2O3��MgO���������У������������������______�����ڼ������������______��
��2������һ�У���������_________���ѧʽ����ͬ������������_________��
��3�����̶��У������ռ��ܽ�SiO2�Ļ�ѧ����ʽΪ_________��
��4����Һ���еĿ���������NaCl��______���ѧʽ������Һ���������ˮ��Ӧ�����ӷ���ʽΪ_____��
��5���ڵ����������ȡ�������ķ�Ӧ�У����������뻹ԭ���������֮��Ϊ______��
���𰸡� SiO2 Fe2O3��MgO Fe(OH)3��Mg(OH)2 Al(OH)3 SiO2+2NaOH=Na2SiO3+H2O NaHCO3 H++NH3��H2O= NH4++H2O��Al3++3NH3��H2O=Al(OH)3��+3NH4+ 8��9
��������(1)Al2O3��SiO2��Fe2O3��MgO���������У������������������SiO2�����ڼ������������Fe2O3��MgO��Al2O3������������ʴ�Ϊ��SiO2��Fe2O3��MgO��
(2)����һ�У�����������������е�Al2O3��Fe2O3��MgO�ܺ����ᷴӦ���ܽ⣬��Һ���к���Al3+��Fe3+��Mg2+�������������������Һ���ֱ�ת��Ϊƫ�����ơ���������������������þ��������˳������к�������������������þ����Һ����ͨ�����������̼����ƫ�����Ʒ�Ӧ�������������������ʳ�����Ϊ�����������ʴ�Ϊ��Fe(OH)3��Mg(OH)2��Al(OH)3��
(3)���̶��У������ռ��ܽ�SiO2�Ļ�ѧ����ʽΪSiO2+2NaOH=Na2SiO3+H2O���ʴ�Ϊ��SiO2+2NaOH=Na2SiO3+H2O��
(4)����(2)�ķ�������Һ���еĿ���������NaCl��NaHCO3�����̶��У������ռ��ܽ�SiO2���������õ������ƺ�ƫ�����Ƶ���Һ������Һ�ຬ�й����ơ�ƫ�����ƺ������������ƣ������м���������ᣬ��Ӧ���ɹ���������Ȼ�����Һ����Һ������Ҫ�����Ȼ��ơ��Ȼ������������ᣬ������Ȼ������ܹ��백ˮ��Ӧ����Ӧ�����ӷ���ʽΪH++NH3��H2O= NH4++H2O��Al3++3NH3��H2O=Al(OH)3��+3NH4+���ʴ�Ϊ��H++NH3��H2O= NH4++H2O��Al3++3NH3��H2O=Al(OH)3��+3NH4+��
(5)�����������ȡ�������ķ�Ӧ����ʽΪ2Al2O3![]() 4Al + 3O2����������������Ϊ��������ԭ����Ϊ��������֮��Ϊ
4Al + 3O2����������������Ϊ��������ԭ����Ϊ��������֮��Ϊ![]() =
=![]() ���ʴ�Ϊ��
���ʴ�Ϊ�� ![]() ��
��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ������У����ϰ�ȫҪ����ǣ� ��
A.��ȼ�ŵľƾ��Ƶ�ȼ��һյ�ƾ���B.��ȼ����ǰ���ȼ��������Ĵ���
C.ϡ��Ũ����ʱ����ˮ����Ũ������D.����������ζʱ����ƿ�����ǿ�����ƿ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʢ��FeCl2��Һ���Թ��У��μӼ���KSCN��Һ�������Ա仯���ټ������������Լ���Һ���죨 ��
A.����B.˫��ˮC.ϡ����D.��ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ѺϽ���Ϊ��ʮһ���͵Ľ��������й㷺����;�������ѿ������з���������
��TiO2��2C��2Cl2![]() TiCl4��2CO
TiCl4��2CO
��TiCl4��2Mg![]() 2MgCl2��Ti
2MgCl2��Ti
������������Ӧ�������й�������ȷ����
A. ��Ӧ����̼Ԫ�ر���ԭ B. ��Ӧ������Ԫ�ر�����
C. ��Ӧ����Cl2�ǻ�ԭ�� D. ��Ӧ����TiCl4��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ö��Ե缫���������Һ���������ŵ��Ľ��У���ҺpH��С����(����)
���Ȼ�����Һ��������ͭ��Һ��������������Һ����ϡ���ᡡ��ϡ���ᡡ����������Һ
A. �٢ۢ� B. �ڢܢ� C. �ڢ� D. �ڢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������л����CH2OH(CHOH)4CHO����CH3(CH2)3OH����CH3��CH��CH2OH����CH2��CH��COOCH3����CH2��CH��COOH�����м��ܷ����ӳɷ�Ӧ���Ӿ۷�Ӧ��������Ӧ�����ܷ���������Ӧ����
A. �ۢ� B. �٢ڢ� C. �ڢ� D. �ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������NaOH��Һ��ȥ���������ʵ���
A. Mg��Al2O3��B. MgCl2��AlCl3��C. Fe��Al��D. Fe2O3��Al2O3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Һ̬��������һ������������ǡ����ȫȼ�գ���Ӧ����ʽΪ��XY2��l��+3O2��g��=XO2��g��+2YO2��g����ȴ���ڱ�״���²��������������672ml���ܶ���2.56g/L��
��1����ӦǰO2�����Ϊ ��
��2��������XY2��Ħ�������� ��
��3����XY2�����У�X��Y��Ԫ�ص�����֮��Ϊ3��16����X��Y��Ԫ�طֱ�Ϊ�� ��дԪ�����ƣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1������������������ѡ����ʵ�һ�飬����Ӧ��ĸ��д�ڿո��ڡ�
A.H2O��Na2O B.�����͵��
C.CuSO4��5H2O D.C2H4��C2H5OH
�������ڻ�������__________�������ε���__________�������л������__________���������������__________��
��2���ڸ���ʱ��ˮ���������ȵ�̿����������ԭ��Ӧ�Ļ�ѧ����ʽ��C+H2O![]() H2+CO��������������__________����ԭ����__________��
H2+CO��������������__________����ԭ����__________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com