
【题目】将浓度均为0.5mol·L-1的氨水和KOH溶液分别滴入到两份均为20mLc1mol·L-1的AlCl3溶液中,测得溶液的导电率与加入碱的体积关系如图所示。下列说法正确的是

A.c1=0.2
B.b点时溶液的离子浓度:c(C1-)>c(NH4+)>c(OH-)>c(H+)
C.ac段发生的反应为:A1(OH)3+OH-==[Al(OH)4]-
D.d点时溶液中:c(K+)+c(H+)==[Al(OH)4]-+c(OH-)
【答案】C
【解析】
导电率与离子浓度成正比,向AlCl3溶液中分别加入氨水和KOH溶液,分别生成Al(OH)3和NH4Cl、Al(OH)3和KCl,当AlCl3完全反应时继续滴加碱,Al(OH)3和KOH反应生成可溶性的KAl(OH)4,一水合氨和Al(OH)3不反应,且一水合氨是弱电解质,则一水合氨溶液导电率较小,所以导电率变化较大的是氨水滴定曲线、变化较小的是KOH滴定曲线,则I为KOH滴定曲线;
A.当AlCl3和KOH恰好完全反应生成Al(OH)3和KCl时,溶液中离子浓度最小,导电率最低,则c点二者恰好完全反应,AlCl3+3KOH=Al(OH)3↓+3KCl,则n(AlCl3):n(KOH)=[c1mol·L-1×20mL]:(0.5mol·L-1×48mL)=1:3,c1=0.4,故A错误;
B.b点溶质为Al(OH)3和NH4Cl,NH4+水解导致溶液呈酸性,则c(OH-)<c(H+),故B错误;
C.ac段为Al(OH)3和KOH的反应,离子方程式为Al(OH)3+OH-═[Al(OH)4]-,故C正确;
D.d点溶液中溶质为KOH、KAl(OH)4、KCl,溶液中存在电荷守恒c(K+)+c(H+)═[Al(OH)4]-+c(OH-)+c(Cl-),故D错误;
故选:C。


科目:高中化学 来源: 题型:
【题目】扁桃酸是唯一具有脂溶性的果酸,实验室用如下原理制备:
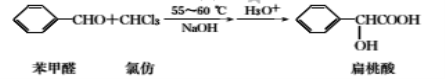
合成扁桃酸的实验步骤、装置示意图及相关数据如下:
物质 | 状态 | 熔点/℃ | 沸点/℃ | 溶解性 |
扁桃酸 | 无色透明晶体 | 119 | 300 | 易溶于热水、乙醚和异丙醇 |
乙醚 | 无色透明液体 | -116.3 | 34.6 | 溶于低碳醇、苯、氯仿,微溶于水 |
苯甲醛 | 无色液体 | -26 | 179 | 微溶于水,能与乙醇、乙醚、苯、 氯仿等混溶 |
氯仿 | 无色液体 | -63.5 | 61.3 | 易溶于醇、醚、苯、不溶于水 |
实验步骤:
步骤一:向如图所示的实验装置中加入0.1mol(约l0.1mL)苯甲醛、0.2mol(约16mL)氯仿,慢慢滴入含19g氢氧化钠的溶液,维持温度在55~60℃,搅拌并继续反应1h,当反应液的pH接近中性时可停止反应。

步骤二:将反应液用200mL水稀释,每次用20mL。乙醚萃取两次,合并醚层,待回收。
步骤三:水相用50%的硫酸酸化至pH为2~3后,再每次用40mL乙醚分两次萃取,合并萃取液并加入适量无水硫酸钠,蒸出乙醚,得粗产品约11.5g。
请回答下列问题:
(1)图中仪器C的名称是___。
(2)装置B的作用是___。
(3)步骤一中合适的加热方式是___。
(4)步骤二中用乙醚的目的是___。
(5)步骤三中用乙醚的目的是___;加入适量无水硫酸钠的目的是___。
(6)该实验的产率为___(保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)![]() 2SO3(g)反应过程中的能量变化如图所示(图中E1表示无催化剂时正反应的活化能,E2表示无催化剂时逆反应的活化能)。下列有关叙述不正确的是
2SO3(g)反应过程中的能量变化如图所示(图中E1表示无催化剂时正反应的活化能,E2表示无催化剂时逆反应的活化能)。下列有关叙述不正确的是

A. 该反应的逆反应为吸热反应,升高温度可提高活化分子的百分数
B. 500℃、101kPa下,将1molSO2(g)和0.5molO2(g)置于密闭容器中充分反应生成SO3(g)放热akJ,其热化学方程式为2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-2a kJ·mol-l
2SO3(g) ΔH=-2a kJ·mol-l
C. 该反应中,反应物的总键能小于生成物的总键能
D. ΔH=E1-E2,使用催化剂改变活化能,但不改变反应热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下联氨(N2H4)的水溶液中存在有:①N2H4+ H2O![]() N2H5++OH- K1②N2H5+ +H2O
N2H5++OH- K1②N2H5+ +H2O![]() N2H6++OH- K2。该溶液中的微粒的物质的量分数(X)随-lg c(OH-)变化的关系如图所示。则下列叙述不正确的是( )
N2H6++OH- K2。该溶液中的微粒的物质的量分数(X)随-lg c(OH-)变化的关系如图所示。则下列叙述不正确的是( )
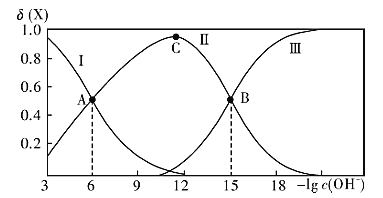
A.图中Ⅲ对应的微粒为N2H62+
B.若C点为N2H5Cl溶液,则存在:c(Cl-)>c(N2H5+ )+2c(N2H62+ )
C.将10mL0.1mol/L的联氨溶液与5mL0.1mol/L.的盐酸溶液混合后,所得溶液pH等于8
D.常温下羟胺(NH2OH)的Kb=10-10,将少量联氨水溶液加入到足量NH3OHCl溶液中,发生的反应为N2H4+NH3OH+=N2H5+ +NH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50mL0.50mol·L-1盐酸与50mL0.55 mol·L -1NaOH 溶液进行中和反应,通过测定反应过程中所放出的热量可计算中和热,下列说法正确的是

A. 在测定中和热的实验中,至少需要测定并记录的温度是3次
B. 大烧杯上如不盖硬纸板,测得的中和热数值会偏小
C. 用相同浓度和体积的氨水代替NaOH 溶液进行上述实验,测得中和热的数值会偏大
D. 从实验装置上看,除了缺少环形玻璃搅拌棒外没有其他问题
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,x、y分别是直流电源的两极,通电后发现a极极板处有无色、无味的气体放出,b极极板质量增加,符合这一情况的是( )
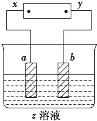
选项 | a极板 | b极板 | x电极 | z溶液 |
A | 锌 | 石墨 | 正极 | CuSO4 |
B | 石墨 | 石墨 | 负极 | NaOH |
C | 石墨 | 银 | 正极 | AgNO3 |
D | 铜 | 石墨 | 负极 | CuCl2 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料,具有广泛的开发和应用前景。在体积可变的密闭容器中投入0.5molCO和1molH2,不同条件下发生反应:CO(g)+2H2(g)![]() CH3OH(g)。实验测得平衡时CH3OH的物质的量随温度、压强的变化如图1所示。下列说法正确的是
CH3OH(g)。实验测得平衡时CH3OH的物质的量随温度、压强的变化如图1所示。下列说法正确的是
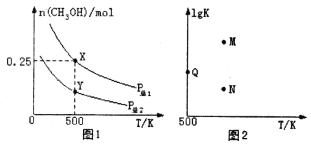
A.P总1<P总2
B.混合气体的密度不再发生变化,说明该反应已达到平衡状态
C.图2中M点能正确表示该反应平衡常数的对数(1gK)与温度的关系
D.若P总1=0.25MPa,则Y点的平衡常数Kp=64(MPa)-2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第三代永磁体材料——钕铁硼(NdFeB)因其优异的综合磁性能,被广泛应用于计算机、通信信息等高科技产业。
(1)铁、钴、镍元素性质非常相似,原子半径接近但依次减小,NiO、FeO的晶体结构类型与氯化钠相同。基态钴原子价电子轨道表示式为_______,熔沸点:NiO_____FeO(填“<”“>”或“=”)。
(2)FeSO4·(NH4)2SO4·6H2O俗称摩尔盐,相对于FeSO4·7H2O而言,摩尔盐不易失水,不易被空气氧化,在化学分析实验中常用于配制Fe(Ⅱ)的标准溶液,硫酸亚铁铵晶体中亚铁离子稳定存在的原因是______________________。
(3)新型储氢材料氨硼烷(NH3BH3)常温下以固体稳定存在,极易溶于水。
①氨硼烷分子中B原子采取_________杂化。
②氨硼烷晶体中存在的作用力有范德华力、极性键、_______和_________。
(4)氨硼烷受热析氢的过程之一如图1所示。

①NH2BH2的氮硼键键能大于NH3BH3,其原因为__________________________。
②CDB的结构简式为___________________________。
③立方氮化硼(BN)晶体的晶胞结构如图2所示。阿伏伽德罗常数值为NA,该晶体的密度为_______g·cm-3(用含a和NA的最简式表示)。图3是立方氮化硼晶胞的俯视投影图,请在图中用“●”标明B原子的相对位置_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温条件下,欲使CH3COONa的稀溶液中![]() 比值增大,可在溶液中加入少量下列物质中的( )
比值增大,可在溶液中加入少量下列物质中的( )
①固体NaOH ②固体KOH ③固体NaHSO4 ④固体CH3COONa ⑤冰醋酸
A.只有①②B.只有③⑤C.只有②④⑤D.只有①⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com