
【题目】已知某温度下,Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.9×10-12,当溶液中离子浓度小于1×10-5mol·L-1时,可认为该离子沉淀完全。下列叙述正确的是( )
A. 饱和AgCl溶液与饱和Ag2CrO4溶液相比,前者的c(Ag+)大
B. 向氯化银的浊液中加入氯化钠溶液,氯化银的Ksp减小
C. 向0.000 8 mol·L-1的K2CrO4溶液中加入等体积的0.002 mol·L-1AgNO3溶液,则CrO42-完全沉淀
D. 将0.001 mol·L-1的AgNO3溶液滴入0.001 mol·L-1的KCl和0.001 mol·L-1的K2CrO4溶液,则先产生AgCl沉淀
【答案】D
【解析】
A项、饱和AgCl溶液中,c(Ag+)=c(Cl-),则c2(Ag+)=Ksp(AgCl)=1.8×10-10,解之得c(Ag+)=1.34×10-5mol/L,饱和Ag2CrO4溶液中c(Ag+)=2c(CrO42-),则c3(Ag+)/2=Ksp(Ag2CrO4)=1.9×10-12,解之得c(Ag+)=1.56×10-4mol/L,显然后者的c(Ag+)大,故A错误;
B项、AgCl的Ksp只与温度有关,向AgCl的浊液中加入氯化钠溶液,虽然平衡向逆方向移动,但Ksp不变,故B错误;
C项、两溶液混合后则c(K2CrO4)=0.0004mol/L,c(AgNO3)=0.001mol/L,根据2Ag++CrO42-=Ag2CrO4↓,则溶液中剩余的c(Ag+)=0.001 mol/L -0.0004 mol/L×2=0.0002mol/L,根据Ksp(K2CrO4),则生成沉淀后的溶液中c(CrO42-)= Ksp(K2CrO4)/ c2(Ag+)=1.9×10-12/(0.0002mol/L)2=2.5×10-5mol/L>1.0×10-5mol/L,溶液中存在难溶物的溶解平衡,所以CrO42-不能完全沉淀,故C错误;
D、根据Ksp(AgCl)、Ksp(Ag2CrO4),则当Cl-开始沉淀时c(Ag+)= Ksp(AgCl)/ c(Cl-)=1.8×10-7mol/L,当CrO42-开始沉淀时c(Ag+)=![]() =4.36×10-5 mol/L,故先产生AgCl沉淀,故D正确。
=4.36×10-5 mol/L,故先产生AgCl沉淀,故D正确。
故选D。


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:
【题目】向25℃时,体积均为20mL浓度均为0.1mol·L-1的两种酸HX、HY溶液中分別滴加0.1mol·L-1的NaOH溶液所加NaOH溶液体积与反应后溶液的pH的关系如图所示。下列叙述正确的是

A. HX、HY均为弱酸
B. Ka(HY)的数量级约为10-6
C. b点时:2c(Na+)=c(Y-)+c(HY)
D. V(NaOH)=20mL时,反应后的两种溶液中c(X-)=c(Y-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四个反应
①2Na+2H2O=2NaOH+H2↑ ②2F2+2H2O=4HF+O2
③Cl2+H2O=HCl+HClO ④C+H2O(g)![]() CO+H2
CO+H2
试从氧化还原的角度,回答下列问题:
(1)水只作还原剂的是__________________(填序号)
(2)二氧化氯(ClO2)是一种在水处理方面有广泛应用的高效安全消毒剂,而且不会产生对人体有潜在危害的物质。工业上可以用如下方法制备ClO2:2NaClO3+H2O2+H2SO4=2ClO2↑+O2↑+Na2SO4+2H2O。反应中氧化剂是____________,生成1.25mol氧化产物共转移电子_________mol。写出该反应的离子方程式_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢材在社会发展中应用广泛。为研究某种碳索钢(含少量碳和硫)的成分,科研小组进行了如下探究活动。
称取碳素钢(已除表面氧化物)24.0g放入耐高温反应管中与O2反应,除去未反应的O2,收集到干燥混合气体X 1.12L(已折算成标准状况下的体积)。
(1)科研小组用下图所示实验装置检验混合气体X的组成。

①装置B中的试剂是___________,装置C的作用是_________。
②若观察到________(填实验现象),证明X中含有CO。
(2)反应后,耐高温反应管内固体中除含有Fe3+之外,还可能含有Fe2+。要确定其中的Fe2+,可选用_______(填序号)。
a.KSCN溶液和氯水 b.KSCN溶液和铁粉
c.稀盐酸和K3[Fe(CN)6]溶液 d.稀H2SO4和KMnO4溶液
(3)科研小组用下图所示装置(部分)测定SO2的体积分数,并计算碳素钢的含碳量。将气体X缓慢通过实验装置,当观察到_____(填实验现象)时,停止通气,此时气体流量仪显示的流量为112mL(已换算成标准状况)。则气体X中SO2的体积分数为_____,碳素钢中碳元素的质量分数为_________(保留1位小数)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向0.1mol/LNaA溶液中逐滴滴加盐酸,测得混合溶液的pH与![]() 变化关系如图所示p
变化关系如图所示p![]() =-lg
=-lg![]() 。下列叙述错误的是
。下列叙述错误的是

A. E点溶液中c(Na+)=c(A-)
B. Ka(HA)的数量级为10-4
C. 滴加过程中![]() 保持不变
保持不变
D. F点溶液中c(Na+)>c(A-)>c(HA)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LiAlH4是金属储氢材料,遇水剧烈反应释放出H2,LiAlH4在125℃时分解为LiH、H2和Al。下列说法正确的是( )
A.LiAlH4中Al的化合价为-5价
B.LiAlH4与水反应时,LiAlH4作还原剂
C.LiAlH4在125℃时完全分解,每生成2mol H2,转移电子数2NA个
D.LiH是反应的还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为二氧化锰的有关转化关系图,下列有关说法中不正确的是( )
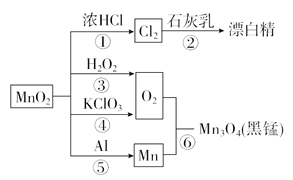
A. 反应①~⑥均属于氧化还原反应
B. 反应⑤中氧化剂与还原剂的物质的量之比为3∶4
C. 相同条件下生成等量的O2,反应③和④转移的电子数之比为1∶1
D. 反应①生成的Cl2经干燥后,可用钢瓶贮运
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组探究铝片做电极材料时的原电池反应,实验如下:
① | ② | ③ |
|
|
煮沸冷却后的溶液 |
电流计指针向右偏转,镁片、铝片表面产生无色气泡 | 电流计指针迅速向右偏转,逐渐向零刻度恢复,经零刻度后继续向左偏转;镁片表面开始时无明显现象,一段时间后有少量气泡逸出;铝片表面持续有气泡逸出。 | 电流计指针向左偏转。铝片表面有气泡逸出,铜片没有明显现象;约3分钟后,铜片表面有少量气泡产生,铝片表面气泡略有减少。 |
下列说法不正确的是
A. 实验①中,镁片做原电池的负极
B. 实验②中,初始时的实验现象对应的原电池反应为:2Mg + O2 + 2H2O ![]() 2Mg( OH) 2
2Mg( OH) 2
C. 实验②中,一段时间后,铝片发生的电极反应式为:Al - 3 e - ![]() Al 3+
Al 3+
D. 实验① ~ ③可推知,铝片做电极材料时的原电池反应与另一个电极的电极材料、溶液的酸碱性、溶液中溶解的O2等因素有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以高纯H2为燃料的质子交换膜燃料电池具有能量效率高、无污染等优点,但燃料中若混有CO将显著缩短电池寿命。
(1)以甲醇为原料制取高纯H2是重要研究方向。甲醇水蒸气重整制氢主要发生以下两个反应:
主反应:CH3OH(g) + H2O(g) ==CO2(g) + 3H2(g) △H = +49 kJmol-1
副反应:H2(g) + CO2(g) ==CO(g) + H2O(g) △H=+41 kJmol-1
①甲醇蒸气在催化剂作用下裂解可得到H2和CO,则该反应的热化学方程式为_________________,既能加快反应速率又能提高CH3OH平衡转化率的一种措施是_________________。
②分析适当增大水醇比![]() 对甲醇水蒸气重整制氢的好处是_______________。
对甲醇水蒸气重整制氢的好处是_______________。
③某温度下,将n(H2O)∶n(CH3OH) = 1∶1的原料气充入恒容密闭容器中,初始压强为P1,反应达平衡时总压强为P2,则平衡时甲醇的转化率为____________(忽略副反应)。
(2)工业上用CH4与水蒸气在一定条件下制取H2,原理为:CH4(g) + H2O(g)=CO(g) + 3H2(g) ΔH = + 203 kJmol-1
①该反应逆反应速率表达式为:v逆=kc(CO) c3(H2),k 为速率常数,在某温度下测得实验数据如表:
CO浓度(molL-1) | H2浓度(molL-1) | 逆反应速率(molL-1min-1) |
0.05 | c1 | 4.8 |
c2 | c1 | 19.2 |
c2 | 0.15 | 8.1 |
由上述数据可得该温度下,该反应的逆反应速率常数 k为_________L3mol-3min-1。

②在体积为3 L的密闭容器中通入物质的量均为3 mol的CH4和水蒸气,在一定条件下发生上述反应,测得平衡时H2的体积分数与温度及压强的关系如图所示:则压强Pl_______P2(填“大于”或“小于”);N点v正_______M点v逆(填“大于”或“小于”);求Q点对应温度下该反应的平衡常数K=________。平衡后再向容器中加入1 mol CH4和1 mol CO,平衡_______移动(填“正反应方向”或“逆反应方向”或“不”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com