
已知通常状况下甲、乙、丙、丁等为气体单质,A、B、C、D、E、F、G、H等为化合物,其中A、B、E、G均为气体,C为常见液体。反应①、②、③都是重要的化工反应,反应④是重要的实验室制取气体的反应。有关的转化关系如下图所示(反应条件均已略去)。

请回答下列问题:
(1)反应④的化学方程式为: ________________________。
(2)B和E在一定条件下可发生反应,这是一个具有实际意义的反应,可消除E对环境的污染,该反应氧化产物与还原产物的物质的量之比为________。
(3)0.1mol lL-1A溶液和0.1mol •L-1 B溶液等体积混合,溶液呈________性,原因是(用离子方程式说明) ________________。
(4)请设计实验检验D晶体中的阳离子(简述实验操作、现象和结论):________________。
(5)pH相同的A、D、H三种溶液,由水电离出的c(OH-)的大小关系是(用A、D、H表示) : ____________。
(6)向一定量的Fe、FeO、Fe3O4的混合物中,加入1mol • L-1 A的溶液100 mL,恰好使混合物全部溶解,且放出336mL(标准状况下)的气体,向所得溶液中加入KSCN溶液,溶液无红色出现;若取同质量的Fe、FeO、Fe3O4混合物,加入1 mol • L-1 H的溶液,也恰好使混合物全部溶解,且向所得溶液中加入KSCN溶液,溶液也无红色出现,则所加入的H溶液的体积是________。
(每空2分,最后一空每空3分,共计15分)
(1)2NH4Cl+Ca(OH)2  CaCl2+2H2O+2NH3↑ (2)2:3
CaCl2+2H2O+2NH3↑ (2)2:3
(3)酸性;NH4++H2O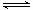 NH3·H2O+H+
NH3·H2O+H+
(4)取一支试管加入适量的D晶体,然后加入适量的NaOH溶液,加热,在试管口放置湿润的红色石蕊试纸,若试纸变蓝,则证明D晶体中含有NH4+
(5)D>A=H (6)110ml
【解析】
试题分析:C为常见液体,则C可能是水。通常状况下甲、乙、丙、丁等为气体单质,则丙和丁应该是氢气和氧气。A和B都是化合物,且都是气体。又因为A和B可以反应生成D,D和F反应生成B、C、I,且该反应是重要的实验室制取气体的反应,由此可以推测,该反应是实验室制取氨气的反应,所以丁是氢气,丙是氧气,B能和氧气反应生成水和E,所以B是氨气,则乙是氮气,A是氯化氢,甲是氯气,D是氯化铵,F是氢氧化钙,I是氯化钙。E是NO,G是NO2,NO2溶于水生成硝酸和NO,则H是硝酸。
(1)反应④的化学方程式为2NH4Cl+Ca(OH)2  CaCl2+2H2O+2NH3↑。
CaCl2+2H2O+2NH3↑。
(2)氨气与NO反应生成氨气和水,反应的化学方程式为4NH3+6NO=5N2+6H2O,其中还原剂是氨气,氧化剂是NO,氮气既是氧化产物,也是还原产物。由于还原剂与氧化剂的物质的量之比是2:3,所以该反应氧化产物与还原产物的物质的量之比也为2:3。
(3)0.1mol lL-1A溶液和0.1mol
•L-1 B溶液等体积混合恰好反应生成氯化铵,溶液中NH4+水解,所以溶液显酸性,反应的离子方程式为NH4++H2O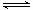 NH3·H2O+H+。
NH3·H2O+H+。
(4)D是氯化铵,阳离子是NH4+,NH4+能和碱反应生成氨气,因此可以通过检验氨气来证明晶体中含有NH4+,所以正确的操作是取一支试管加入适量的D晶体,然后加入适量的NaOH溶液,加热,在试管口放置湿润的红色石蕊试纸,若试纸变蓝,则证明D晶体中含有NH4+。
(5)盐酸和硝酸都是酸抑制水的电离,在二者浓度相同的条件下对水的抑制程度相同。氯化铵是强酸弱碱盐,溶于水NH4+水解,促进水的电离,所以pH相同的A、D、H三种溶液,由水电离出的c(OH-)的大小关系是D>A=H。
(6)溶液中均没有出现红色,则溶液中的溶质分别是氯化亚铁和硝酸亚铁,且二者的物质的量均是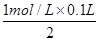 =0.05mol。336ml气体是氢气,其物质的量是0.336L÷22.4L/mol=0.015mol,则根据电子转移相等可知,被还原的硝酸的物质的量是
=0.05mol。336ml气体是氢气,其物质的量是0.336L÷22.4L/mol=0.015mol,则根据电子转移相等可知,被还原的硝酸的物质的量是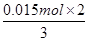 =0.01mol,所以根据氮原子守恒可知,硝酸的物质的量是0.05mol×2+0.01mol=0.11mol,因此硝酸的体积是0.11mol÷1mol/L=0.11L=110ml。
=0.01mol,所以根据氮原子守恒可知,硝酸的物质的量是0.05mol×2+0.01mol=0.11mol,因此硝酸的体积是0.11mol÷1mol/L=0.11L=110ml。
考点:考查无机框图题的推断、氨气制备、NH4+检验、盐类水解、外界条件对水电离平衡的影响以及氧化还原反应的有关计算等


 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:
A、B、C、D、E、F均为短周期元素,且原子序数依次增大,A是原子半径最小的元素,B的最髙价氧化物的水化物可与其氢化物反应形成离子化合物甲;A与D可以按照原子个数比4 : 1形成化合物乙,且乙分子中含有18个电子,E与B同主族,C的阳离子与F的阴离子相差一个电子层,且可形成离子个数比为
2 : 1的离子化合物丙。
(1) D的原子结构示意图为 (1分),丙的电子式为 ,E在周期表中的位置为 (2分)。
(2) 下列说法正确的有 (2分)。
①化合物乙为正四面体形分子,是由极性键构成的非极性分子
②C、D、E、F原子半径由大到小的顺序为C>D>E>F
③B、E形成的氢化物中,B的氢化物稳定性更强,是因为该分子中存在氢键
④化合物甲和化合物丙都含有离子键和共价键
(3) 已知通常状况下1gF在空气中完全燃烧放出a kj的热量,请写出表示F燃烧热的热化学方程式 。将燃烧产物通入BaCl2和HNO3的混合溶液,生成白色沉淀并放出无色气体,请用一个离子方程式表示该反应 (2 分)。
(4) 写出一个由以上元素构成的1Oe-微粒与18e-微粒反应的离子方程式:
及其他合理答案。
查看答案和解析>>
科目:高中化学 来源:2011届湖南省雅礼中学高三第六次月考理综化学部分 题型:填空题
A、B、C、D、E、F均为短周期元素,且原子序数依次增大,A是原子半径最小的元素,B的最髙价氧化物的水化物可与其氢化物反应形成离子化合物甲;A与D可以按照原子个数比4 : 1形成化合物乙,且乙分子中含有18个电子,E与B同主族,C的阳离子与F的阴离子相差一个电子层,且可形成离子个数比为
2 : 1的离子化合物丙。
(1) D的原子结构示意图为 (1分),丙的电子式为 (2分),E在周期表中的位置为 (2分)。
(2) 下列说法正确的有 (2分)。
①化合物乙为正四面体形分子,是由极性键构成的非极性分子
②C、D、E、F原子半径由大到小的顺序为C>D>E>F
③B、E形成的氢化物中,B的氢化物稳定性更强,是因为该分子中存在氢键
④化合物甲和化合物丙都含有离子键和共价键
(3) 已知通常状况下1gF在空气中完全燃烧放出a kj的热量,请写出表示F燃烧热的热化学方程式 (2分)。将燃烧产物通入BaCl2和HNO3的混合溶液,生成白色沉淀并放出无色气体,请用一个离子方程式表示该反应 (2 分)。
(4) 写出一个由以上元素构成的1Oe-微粒与18e-微粒反应的离子方程式:
(2分)及其他合理答案。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年河南省辉县市高三上学期第四次月考理综化学卷 题型:填空题
(14分)A、B、C、D、E、F均为短周期元素,且原子序数依次增大,A是原子半径最小的元素,B的最高价氧化物的水化物可与其氢化物反应形成离子化合物甲;A与D可以按照原子个数比4∶1形成化合物乙,且乙分子中含有18个电子,E与B同主族,C的阳离子与F的阴离子相差一个电子层,且可形成离子个数比为2:1的离子化合物丙。
(1)D的原子结构示意图为__________________,丙的电子式为____________________,E在周期表中的位置为_____________。
(2)下列说法正确的有__________________________
① 化合物乙为正四面体形分子,是由极性键构成的非极性分子
② C、D、E、F原子半径由大到小的顺序为 C> D >E> F
③ B、E形成的氢化物中,B的氢化物稳定性更强,是因为该分子中存在氢键
④ 化合物甲和化合物丙都含有离子键和共价键
(3)已知通常状况下1g F在空气中完全燃烧放出a kJ的热量,请写出表示F燃烧热的热化学方程式 。将燃烧产物通入BaCl2和HNO3的混合溶液,生成白色沉淀并放出无色气体,请用一个离子方程式表示该反应____________。
(4)写出一个由以上元素构成的10e-微粒与18e-微粒反应的离子方程式:
___________________________________________________________________
查看答案和解析>>
科目:高中化学 来源:2010年重庆市高三上学期第二次月考理综化学卷 题型:填空题
A、B、C、D、E、F均为短周期元素,且原子序数依次增大,A是原子半径最小的元素,B的最高价氧化物的水化物可与其氢化物反应形成离子化合物甲;A与D可以按照原子个数比4∶1形成化合物乙,且乙分子中含有18个电子,E与B同主族,C的阳离子与F的阴离子相差一个电子层,且可形成离子个数比为2:1的离子化合物丙。
(1)D的原子结构示意图为__________________,丙的电子式为____________________,E在周期表中的位置为__________________________________。
(2)下列说法正确的有__________________________
① 化合物乙为正四面体形分子,是由极性键构成的非极性分子
② C、D、E、F原子半径由大到小的顺序为 C> D >E> F
③ B、E形成的氢化物中,B的氢化物稳定性更强,是因为该分子中存在氢键
④ 化合物甲和化合物丙都含有离子键和共价键
(3)已知通常状况下1g F在空气中完全燃烧放出a kJ的热量,请写出表示F燃烧热的热化学方程式 。将燃烧产物通入BaCl2和HNO3的混合溶液,生成白色沉淀并放出无色气体,请用一个离子方程式表示该反应_ ___。
(4)写出一个由以上元素构成的10e-微粒与18e-微粒反应的离子方程式:
_____________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com