
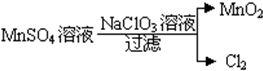
分析 (1)NaN3+KNO3→K2O+Na2O+X中,结合原子守恒、X为单质可知,X为N2,只有N元素的化合价变化;
(2)由转化可知,Mn元素的化合价由+2价升高为+4价,Cl元素的化合价由+5价降低为0,结合电子、电荷守恒配平.
解答 解:(1)NaN3+KNO3→K2O+Na2O+X中,结合原子守恒、X为单质可知,X为N2,KNO3中N元素的化合价降低,则KNO3为氧化剂,
故答案为:KNO3;N2;
(2)由转化可知,Mn元素的化合价由+2价升高为+4价,Cl元素的化合价由+5价降低为0,由电子、电荷、原子守恒可知离子反应为5Mn2++2ClO3-+4H2O=5MnO2↓+Cl2↑+8H+,故答案为:5Mn2++2ClO3-+4H2O=5MnO2↓+Cl2↑+8H+.
点评 本题考查氧化还原反应,为高频考点,把握发生的反应及反应中元素的化合价变化等为解答的关键,侧重分析与应用能力的考查,注意守恒法应用,题目难度不大.


 活力课时同步练习册系列答案
活力课时同步练习册系列答案科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 实验 装置 图 | 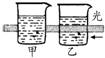 |  | 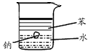 | 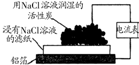 |
| 主要 现象 | 乙装置中有光亮通路,甲装置无明显现象 | 两试管中都有气泡产生,但乙比甲速率快 | 钠在水与苯层之间上下跳动,且有气泡产生 | 电流表指针发生偏转 |
| 实验 结论 | 乙装置中分散系为胶体,甲装置中分散系不是胶体 | 可验证FeCl3对H2O2分解反应有催化作用 | 证明密度ρ(苯)<ρ(钠)<ρ(水) | 电子从铝箔流出,经电流表、流到活性炭 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A、B、C最简单氢化物的沸点依次递减,是因为A、B、C非金属性依次递减 | |
| B. | EB晶体是一种坚硬的高熔点材料,熔化时需克服离子键 | |
| C. | 在一定条件下,B的氧化物与B的简单氢化物均能反应生成单质B | |
| D. | C、D的常见氧化物均能溶于氢氧化钠溶液中,则C、D的氧化物均属于酸性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验目的 | 实验操作 | |
| A | 验证淀粉已水解 | 在淀粉溶液中加入稀硫酸,水浴加热,一段时间后,再加入新制的银氨溶液并水浴加热 |
| B | 比较醋酸和次氯酸的酸性强弱 | 用PH试纸测定0.1mol•L-1醋酸钠溶液和0.01mol•L-1次氯酸钠溶液的PH |
| C | 证明Cl2的氧化性比Br2氧化性强 | 0.1mol•L-1 NaBr溶液中加入适量的新制氯水,反应后再加入适量的四氯化碳,振荡,观察下层液体的颜色 |
| D | 除去苯中混有的少量苯酚 | 向其中加入适量的溴水再过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+ | B. | SO42- | C. | Ba2+ | D. | Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用量筒量取30mL溶液 | B. | 用四氯化碳萃取碘水中的碘 | ||
| C. | 用托盘天平称取2.5g固体 | D. | 用温度计代替玻璃棒搅拌溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12溶液.Na+、SO32一、ClO-、CO32- | |
| B. | 能与金属铝反应放出氢气的溶液中:K+、Fe2+、Cl-、NO3- | |
| C. | 0.1mol/LBa (OH)2溶液中:Al3+、NH4+、NO3-、HCO3- | |
| D. | 0.1mol/L AlO2-溶液中:Na+、K+、SO32一、CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com