


科目:高中化学 来源: 题型:
| A、常温下,将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 |
| B、温度一定时,向水中滴加少量酸或碱形成稀溶液,水的离子积常数Kw不变 |
| C、8NH3(g)+6NO2(g)═7N2(g)+12H2O(g)△H<0,则该反应一定能自发进行 |
| D、由于Ksp(BaSO4)<Ksp(BaCO3),因此不可能使BaSO4沉淀转化为BaCO3沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
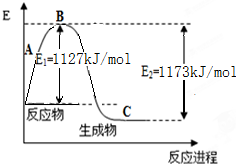 氨气是一种重要的化工原料,工业上用N2和H2合成NH3.现已知N2(g)和H2(g)反应生成1mol NH3(g)过程中能量变化示意图如图.回答下列问题:
氨气是一种重要的化工原料,工业上用N2和H2合成NH3.现已知N2(g)和H2(g)反应生成1mol NH3(g)过程中能量变化示意图如图.回答下列问题:| 化学键 | H-H | N≡N |
| 键能(kJ、mol) | 436 | 946 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 如图1所示,相同体积的a、b、c三密闭容器,其中c容器有一活塞,a、b两容器为定容容器,起始向三容器中都加入相同量的N2和H2使三容器压强相等,一定条件下发生N2+3H2?2NH3的反应.问:
如图1所示,相同体积的a、b、c三密闭容器,其中c容器有一活塞,a、b两容器为定容容器,起始向三容器中都加入相同量的N2和H2使三容器压强相等,一定条件下发生N2+3H2?2NH3的反应.问:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在标准状况下,1mol水的体积约为22.4L |
| B、标准状况下,氧气的气体摩尔体积约为22.4L?mol-1 |
| C、常温常压下,1mol氢气的体积为22.4L |
| D、常温常压下,1mol氧气的质量为32克 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com