
【题目】对乙酰氨基苯酚(F)是最常用的非甾体消炎解热镇痛药,用于治疗感冒发烧、关节痛、神经痛、偏头痛等,它可用最简单的烯烃A等合成:
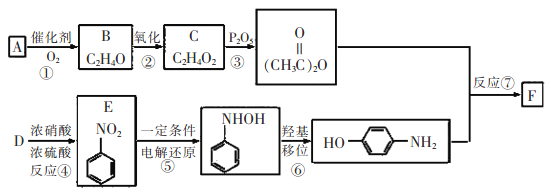
已知:![]()
请回答下列问题:
(1)E的名称为__________,C中含有的官能团是__________。
(2)B的结构简式是__________,反应③的反应类型是__________。
(3)F与足量NaOH溶液反应的化学方程式为__________。
(4)F的同分异构体有很多,其中一类同时满足下列条件的同分异构体共有_______种。
①苯环上有三个侧链;②与FeCl3溶液发生显色反应;③能发生银镜反应且醛基直接连在苯环上。
(5)参照F的合成路线,设计一条以溴苯为起始原料制备![]() 的合成路线___________。
的合成路线___________。
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】高纯碳酸锰在电子工业中有重要的应用,湿法浸出软锰矿(主要成分为MnO2 , 含少量Fe、Al、Mg等杂质元素)制备高纯碳酸锰的实验过程如下: 
(1)浸出:浸出时温度控制在90℃~95℃之间,并且要连续搅拌3小时的目的是 , 植物粉的作用是 .
(2)除杂:①向浸出液中加入一定量的碳酸锰矿,调节浸出液的pH为3.5~5.5; ②再加入一定量的软锰矿和双氧水,过滤;
③…
操作①中使用碳酸锰调pH的优势是;操作②中加入双氧水不仅能将Fe2+氧化为Fe3+ , 而且能提高软锰矿的浸出率.写出双氧水提高软锰矿浸出率的离子方程式 .
(3)制备:在30℃~35℃下,将碳酸氢铵溶液滴加到硫酸锰净化液中,控制反应液的最终pH在6.5~7.0,得到MnCO3沉淀.温度控制35℃以下的原因是;该反应的化学方程式为;生成的MnCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是 .
(4)计算:室温下,Ksp(MnCO3)=1.8×10﹣11 , Ksp(MgCO3)=2.6×10﹣5 , 已知离子浓度小于1.0×10﹣5molL﹣1时,表示该离子沉淀完全.若净化液中的c(Mg2+)=10﹣2mol/L,试计算说明Mg2+的存在是否会影响MnCO3的纯度.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表与元素周期律在学习、研究和生产实践中都有非常重要的作用。下表(元素周期表前三周期的一部分)列出了①~⑦七种元素在周期表中的位置。
① | ② | ③ | |||
④ | ⑤ | ⑥ | ⑦ |
请回答:
(1)②所代表元素的名称为______
(2)七种元素中,非金属性最强的元素是______(填元素符号),最高价氧化物的水化物酸性最强的是_______(填化学式),最高正化合价与最低负化合价的代数和为4的元素是_______(填元素符号)。
(3)②、④、⑥所对应元素中原子半径最小的是______(填元素符号),简单离子半径最大的是______(填离子符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在周期表中找到第3横行17纵行的元素,回答下列问题:
(1)该元素的符号是________,其原子结构示意图为________
(2)该元素位于第________周期,第________族。
(3)写出下列反应的化学方程式:
①该元素的单质+水:_______________________________________;
②该元素的单质+氢氧化钠:_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. ![]() 的一溴代物和
的一溴代物和![]() 的一溴代物都有4种(不考虑立体异构)
的一溴代物都有4种(不考虑立体异构)
B. CH3CH=CHCH3分子中的四个碳原子在同一直线上
C. 按系统命名法,化合物 的名称是2,3,4-三甲基-2-乙基戊烷
的名称是2,3,4-三甲基-2-乙基戊烷
D. ![]() 与
与![]() 都是α-氨基酸且互为同系物
都是α-氨基酸且互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组探究SO2气体还原Fe3+、I2 , 他们使用的药品和装置如下图所示: 
(1)装置C的作用是 .
(2)若要从FeSO4溶液获得FeSO47H2O晶体,必须进行的实验操作步骤:、、过滤、洗涤、自然干燥.
(3)根据以上现象,该小组同学认为SO2 与 FeCl3溶液发生氧化还原反应. ①写出SO2与FeCl3溶液反应的离子方程式;
②请写出检验A烧杯中有Fe2+生成的操作方法;
③该小组同学向C烧杯反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO42﹣ . 该做法(填“合理”或“不合理”),理由是 .
(4)能表明I﹣的还原性弱于SO2的现象是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是可逆反应X2+3Y22Z在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( ) 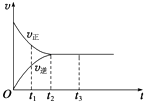
A.t1时,只有正方向反应
B.t2时,反应达到限度
C.t2~t3 , 反应不再发生
D.t2~t3 , 各物质的浓度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H、C、N、O、Na、Fe、Cu是常见的七种元素。
(1)N、Na+、Fe3+、Cu2+四种微粒基态的核外电子排布式中未成对电子数最多的是____________。
(2)根据价层电子对互斥理论判断下列分子或离子中空间构型是V形的是______(填写序号)。
a. ![]() b.
b. ![]()
c. ![]() d.
d. ![]()
(3)分子(CN)2中键与键之间的夹角为180°,并有对称性,分子中每个原子最外层均满足8电子稳定结构,其结构式为___________,1个分子中含有_________个π键。
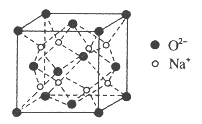
(4)O和Na形成的一种只含有离子键的离子化合物,其晶胞结构如图,该离子化合物的化学式为_____________。已知该晶胞的密度为ρg/cm3,阿伏加德罗常数为NA,求晶胞边长![]() _______cm。(用含ρ、NA的代数式表示)
_______cm。(用含ρ、NA的代数式表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com